Az ionos terméket víz
Víz, hogy egy nagyon gyenge elektrolit, disszociál ionokra egy nagyon kis mértékben:
Ez a folyamat által leírt egyensúlyi állandója az egyensúlyi:
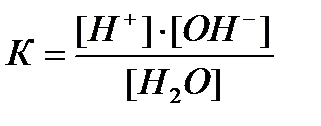
ahol K - állandó a disszociációs víz. A 22 0 C-on ez egyenlő 1,8 # 8729; 10 -16.
Mivel a disszociációs mértéke víz nagyon kicsi, a (1) egyenlet a víz koncentrációja [H 2O] lehet tekinteni, mint egy állandó értéket
,
ahol kW - ionos terméket víz.
Behelyettesítve a k értékeket és a [H2 O] a (2) egyenletben megkapjuk a számértéke ion termék vízben 22 0 C-on
Kw = [H +] [OH -] = 1,8 # 8729; 10 -16 # 8729; = 10 -14 55.56
KW függés hőmérsékletet mutatja a következő adatok:
t, C 0 10 22 30 50 100
KW 0,36 × 10 -14 1,00 × 10 -14 1,89 × 10 -14 5,6 × 10 -14 74 × 10 -14
Így, KW - állandó érték csak akkor, ha egy adott hőmérsékleten.
Megoldások, amelyekben a hidrogénionok koncentrációját és a hidroxid-ionok egyenlő, az úgynevezett semleges oldatokban. A 22 0 C-on semleges oldatokban, mint a hidrogénionok koncentrációját és a hidroxid-ionok 10 -7 mol / l. A savas oldatokban felett hidrogénionok koncentrációját lúgos - a koncentráció-hidroxid-ionok. De bármi is az oldatot a reakció terméke a hidrogénionok koncentrációját és a hidroxid - ion állandó marad.
Ebből következik, hogy a savasság foka és mértéke bázicitást fejezhető ki koncentrációjának ionok H + vagy OH -:
A semleges oldatot [H +] = 10 -7 mol / l,
A savas oldatot [H +]> 10 -7 mol / l,
A lúgos oldatot [H +] <10 -7 моль/л.
Annak elkerülése érdekében, a kapcsolatos hátrányok a számok használatát negatív kitevőket, a hidrogénion-koncentráció általában kifejezve a pH-értéket, és Jele pH.
PH nevezett logaritmusát a hidrogénion-koncentráció, figyelembe az ellenkező megjelölés:
pH = -lg [H +] és [H +] = 10 -pH
ahol [H +] - hidrogén-ion-koncentráció, mól / liter.
Hidroxil-index pOH úgynevezett koncentrációja logaritmusának a hidroxid-ionok, figyelembe az ellenkező megjelölés:
pOH = - lg [OH -] vagy [OH -] = 10 -rON
ahol [OH -] - koncentrációja hidroxidion mol / l.
pH + pOH = 14; pOH = 14 - pH.
Világos, hogy a kapcsolat a hidrogénionok koncentrációját, a pH-érték és a reakcióelegyet kifejezhető egy diagram

A rendszer azt mutatja, hogy minél alacsonyabb a pH, annál nagyobb a koncentrációja H + ionok. azaz magasabb savasság; Fordítva, minél nagyobb a pH, annál kisebb a koncentrációja H + ionok. t. e. nagyobb lúgosság.