A működési elve az ólom-sav akkumulátor
akkumulátorok
A működési elve az ólomakkumulátor
Az áramforrást a jármű működése alapjáraton vagy kis forgási sebesség a motor főtengely egy akkumulátort. Jelenleg az autók leggyakrabban használt ólom-savas akkumulátorok állhat több sorba kapcsolt elemeket. Alkalmazás savas akkumulátorok, mert van egy kis belső ellenállás és képesek rövid ideig (néhány másodperc), így a jelenlegi több száz amperes, szükséges, hogy a kínálat az önindító amikor elindítja a motort.
Ólom akkumulátor villamosenergia találták 1859-ben a francia fizikus Gaston Plante. Az ezt követő években, az akkumulátor design - különösen a kémiai összetétele: az elektródok (lemezek) folyamatosan javul. Jelenleg ólom-savas akkumulátorok és az újratölthető akkumulátorok széles körben használják a különböző műszaki területeken, mint az elektromos energiatároló eszköz (targonca akkumulátor, valamint a vészhelyzeti tartalék áramforrásokat, és így tovább. P.).
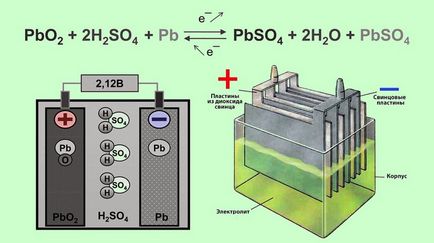
Szerkezetileg, az akkumulátor egy tartályba töltött elektrolit, amelyekben az ólom elektródák vannak elrendezve. Az elektrolit egy kénsav-oldattal és desztillált vízzel. Az elektródok formájában lemezek, amelyek közül az egyik készült a szivacsos ólom Pb. és a második - PbO2 ólom-dioxid. A kölcsönhatás elektródák az elektrolittal potenciálkülönbséget következtében növekszik.
A működési elve ólom-savas akkumulátorok alapuló elektrokémiai reakciók ólom és ólom-dioxid vizes kénsav-oldattal.
Amikor csatlakoztatva külső terhelés akkumulátor elektródák kezdődik elektrokémiai reakció között ólom-oxid és a kénsav, és a fémes vezető oxidáljuk ólom-szulfát.
Közben kisülés jön létre helyreállítási ólom-dioxid a pozitív elektród (anód), és az oxidációt a vezetést a negatív elektród (katód). Amikor áthalad az elektródák az akkumulátor töltőáram azt vissza áramló reakciókat. Amikor az akkumulátor töltésére, ólom-szulfát kimerítése után megkezdi a víz elektrolízisével, oxigén szabadul míg az anód és a katód - hidrogénatom.
Elektrokémiai reakciók (balról jobbra haladva - a mentesítési, jobbról balra - díj ellenében):
Reakció az anód:
Reakció a katódon:
Fizikai folyamatok játszódnak le az akkumulátort, elektrolitikus oldódási tulajdonság magyarázható fémek, amely mozgatni pozitívan töltött fémionok oldatban. Könnyen oxidálódó fémek (például ólom) rendelkeznek az ingatlan nagyobb mértékben, mint a nemesfémek.
Amikor ólom elektródát bemerítjük a elektrolit oldatot elválasztjuk akkor pozitív töltésű és a vezető ionok oldatba megy, maga az elektród negatív töltésű.
Mivel a folyamat során növeli a potenciális különbség az oldathoz, és az elektróda, és az átmenet a pozitív ionok az oldatban lelassul.
Amikor egy adott potenciális különbség az elektróda és az oldat közötti egyensúly rugalmas ereje elektrolitikus oldódási ólom, egyrészt, és az erők a elektrosztatikus mező és az ozmotikus nyomást - más.
Ennek eredményeként az átmenet ólomionoktól az elektrolitban leáll.
Amikor merítjük készült elektródot ólom-dioxid a kénsav oldat van ugyanazt a folyamatot, de az eredmény eltérő. Az ólom-dioxid korlátozott számban oldatba, ahol a vízzel elegyítve ionizálódik tetravalens ólomionoktól RV4 + és egyértékű hidroxil ionok OH.
Tetravalens ólomionoktól kicsapjuk az elektród létrehoz egy pozitív potenciál képest az oldathoz. Kénsav formák vízben lényegében csak HO + ionok és HSO4.
Ily módon, amikor az akkumulátor kisülés elhasznált kénsav, víz képződik, és mindkét elektróda - ólom-szulfát. Amikor a töltés folyamatok folytassa az ellenkező irányba.
Amikor csatlakoztatja a fogyasztók az akkumulátor kisülési áram lép fel. Az ionok a kénsav maradékot SO4 kapcsolódik ólom kialakított elektródákat, és ólom-szulfátot PbSO4. és a hidrogén-ionok az oxigénnel összekeverednek, állt ki a pozitív lemezen víz keletkezik.
Ennek eredményeként, az elektródákat borított ólom-szulfát és kénsav vízzel hígítjuk, azaz. E. Amikor az akkumulátor lemerül, az elektrolit sűrűsége csökken. Ezért a sűrűsége az elektrolit látható a töltöttségi szintet.
Befejezését követően az ólom elektródák az akkumulátor töltöttségi leáll. A további átfolyó villamos áram segítségével a elektrolit elektrolizáló eljárás indul (expanziós) a víz, míg az akkumulátor „forraljuk” és a forma buborékok fejlődött keveréke hidrogén és oxigén. A gáz keveréke robbanásveszélyes, így elkerülhető a túltöltést jelenségek az elektrolízis előtt a víz bomlik.
Ezen túlmenően, hosszabb túltöltés elvesztéséhez vezet elektrolit vizet (párolgás), miáltal a sűrűség növekszik és szükséges módosítások csereléséhez desztillált vízzel.
A feltöltések során vizet kell arra, hogy a víz belépő tömény kénsav, forrásban lévő és erősen savas spray-k cseppeket, amelyek érintkező nyitott testtel vagy a ruházattal is okozhat bőr égési, nyálkahártya égési ruhák és egyéb kellemetlen következményekkel jár.
Konstans feszültség a töltés áram forrás fokának növeléséhez az akkumulátor töltöttségi növeli elektromotoros ereje és így csökkentett teljesítmény töltőáramot. Ha a feszültség a jelenlegi forrás terminálok egyenlő egy teljesen feltöltött akkumulátor elektromotoros plusz polarizációs feszültséget, a töltőáram leáll.
Az átlagos értéke az akkumulátor feszültsége - 2 B. Mivel az elektromos korszerű járművek üzemelésre tervezett rendszer feszültsége a 12 vagy 24 V-os akkumulátort egyesítjük egy akkumulátort (6 vagy 12 db.).
Az egyik fontos paraméter az akkumulátor kapacitását, azaz a. E. A villamos energia mennyiség, amely képes adni az akkumulátort. Kapacitás - a munkaerő idejére a kisülési áram a megengedett maximális mentesítés lemerült állapotban. Mért akkumulátor kapacitása amper-óra (A × h). Az akkumulátor kapacitása elsősorban attól függ, az aktív terület: az elektródok.
Ezért, a kapacitás növekedését lehet elérni növelésével az elektród felületén, ami úgy érhető el, ha több összekapcsolt párhuzamos lemezek, és az alkalmazás a porózus anyag a gyártásukhoz, amely lehetővé teszi, hogy használja, mint az aktív tömeg, nem csak a felszínen, hanem a belső térfogata a lemezeket.
Az akkumulátor kapacitása nem állandó, ez függ az erőssége a kisülési áram, elektrolit hőmérséklete és az állam aktív felületei a lemezeket. Növelésével a kisülési áram, és a hőmérséklet az elektrolit csökken az akkumulátor kapacitása csökken a hiányos mentesítés az elektrokémiai reakció ilyen körülmények között, köszönhetően csökken a kisütési idő, és fokozza a viszkozitás az elektrolit alacsony hőmérsékleten.