A hatásmechanizmus enzimek
A hatásmechanizmus enzimek
Enzimatikus nyilvánul fehérje természetét enzimek, azok hőre érzékenynek, a pH hatását, a hatása specifikus, nagy katalitikus képessége, érzékenység a inhibitorok és aktivátorok. Az enzimes reakció játszódik le a törvény szerint a tömeghatás.
Az enzimek és az aktiválási energia. Enzimek - biológiai katalizátorok. Ezek befolyásolják a reakció sebessége a két irányban felgyorsítja a szintézis vagy hasítása bizonyos anyagok. Növelése a reakciósebesség változása miatt az energia szubsztrátumok aktiválását molekulák. Az aktivációs energia E jellemzi az energia akadályt, amely le kell győzni ahhoz, hogy a reagensek, hogy az aktív állapot. Ez okozza az intermolekuláris erő intermolekuláris kapcsolási vagy taszítás a reagensek. A reakció sebessége növelhető számának növelésével aktivált molekulák vagy csökkenti az energia gáton magassága.
Hordozóanyag molekulák hozhatók aktív állapotban azáltal, különböző módszerekkel. Egyikük melegítjük, miáltal a megoldások növekvő molekulák sebessége és a lehetőséget a kapcsolatot. Amikor a katalizátor jelenlétében redukáljuk, és az energia gáton aktiválási energia (Color. Táblázat. IV). Így, hasítása szacharózt glükóz és a fruktóz hatására kénsav E = 134.400 J / mol, és részvételével az invertáz - 40420 J / mol. A hidrolízist sósavval kazein
sav E = 109.200 J / mol, pepszin - 50 400 J / mól. A aktiválási energia a hidrogén-peroxid bomlását (. Ábra 40) katalizátor nélkül 75 600 J / mol (E1), kolloidális platina - 49 140 (E2), a máj kataláz - 23 100 J / mol (E3).
Az elmélet enzimatikus. katalíziseljárások nagyobb mértékben magyarázza az elmélet a Michaelis - Menten. Ezen elmélet szerint, négy szakaszból áll.
I. szakaszban. A szubsztrátum (S) és enzim (E), van egy kapcsolat - képződött enzim-szubsztrát komplex ES, amelyben a alkatrészek egymáshoz kovalens, ionos, hidrogén és más kötések.
Stage II. A szubsztrát mellékelt hatása alatt az enzim aktiválódik, és elérhetővé válik a megfelelő ES katalizátoros reakcióval.
Stage III. Végzett katalízis ES *.
Stage IV. E mentesített enzimmolekulában és reakciótermékek P.
A sorozat a transzformációk tükrözik a következő séma szerint:
Az elmélet enzimatikus megerősítette a kisérlet. Például, torma izolált enzim, amely hasítja a hidrogén-peroxid - peroxidáz barna. Miután az enzimet E hozzuk a szubsztráttal H2 O2 (S) van egy enzim-szubsztrát komplex ES zöld. Egy idő után a hordozó aktív alkotnak az aktivált enzim-szubsztrát ES * vöröses szín. Hasad barna enzim E és a szétesési termékek P.
Az aktív helyén az enzim. enzim részecskéket
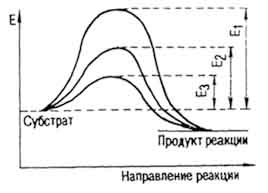
Ábra. 40. Csökkentett aktivációs energia egy katalizátor (E. Hoffman)
van nagy tartalékok a szabad energia és adszorbeálni képes a felületen molekulák vagy csoportok, szubsztrátok, amelynek méretei a legtöbb esetben sokszor kisebb, mint a méret az enzim-molekula. A reakcióban az enzim és a szubsztrát részecskemérete megváltoztatja annak konfigurációja -, amelynek sajátos mélyedés, és amelyben van kialakítva egy enzim-szubsztrát komplex. Ez a rész az enzim nevű molekula substratsvyazyvayuschim része. Allokált részét az enzim-molekula végző katalízis, - aktív hely. Molekularész egy enzim, amely kötődik az alacsony molekulatömegű metabolitok vagy effektorok megváltoztatásával a tercier struktúráját, és gátolják a nevű enzim alloszterikus központ. A legtöbb enzim van egy, néhány - a két vagy több aktív hely. Substratsvyazyvayuschy és aktív centrumok gyakran földrajzilag egybeesnek. A molekulák tripszin és karboxipeptidáz egy aktív centrum, gliceraldehid - 2, ureáz - 3-4, kolinészteráz - 20-100.
Az aktív centrum csoportokat tartalma, amelyek hordozzák szoros kölcsönhatás részecskéi között a szubsztrátum és az enzim. Ezek képesek csökkenteni az aktiválási energia és előállítjuk az első komplex ES, ES * majd végül, E és P. Egyszerű enzimek képződését az aktív centrum érintett protein funkciós csoportok komplex enzimek - és a megfelelő kofaktorokat. Az aminosav-maradékok az aktív központban lehet osztani három. Némelyikük hordozza a csoportok ható a szubsztrát a katalízis során, mások, hogy közötti érintkezés az enzim és a szubsztrát, a harmadik működnek pusztán strukturális szerepet játszik a harmadlagos szerkezetét az enzim-molekula. A katalitikus esemény egyfajta által kiváltott „vágás” a szubsztrátum (néha inhibitor), hogy az aktív hely (ábra. 41).
A kémia a aktív helyén interakció a szubsztrát leginkább széles körben tanulmányozták az acetilkolinészteráz (AChE). Ez utal egyszerű enzimek. Az aktív központja molekulájában (. Ábra 42, A) tartalmaz legalább négy aminosavból: szerin, hisztidin, tirozin és a glutaminsav. Az I. szakaszban
Ábra. 41. reakcióvázlat által kiváltott "fit" az enzim és a szubsztrát, az enzim és az inhibitor) D. B. Moss, J. L .. Vattervortu)
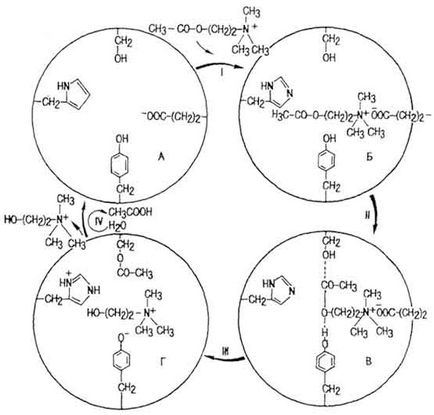
Ábra. 42. A hatásmechanizmusa kolinészteráz (az YB Philipovich)
AChE kölcsönhatásba lépve neurális gerjesztési mediátor acetilkolin (AX) enzim komplex bekövetkezik - AX (42. ábra, B.). A Stage II komplex aktiválja a kölcsönhatás a szerin és tirozin maradékok az aktív centrum a molekula és az AX (ábra. 42 B). Az energia gát csökkentett (ott ES *). A szakaszban III hatása alatt a csoport hisztidin húzta proton a hidroxil-tirozin, egy észterkötés kialakítása a szerin-maradék és egy acetilcsoport AX, megszakítja a kapcsolatot a maradék ecetsavat és a maradékot a kolin (ábra. 42, L. lépésben IV hidrolizáljuk ES * -komplex. kinyerjük az aktív centrumban AChE, megkülönböztetett kolin és ecetsav. hidrolízis AX fordul elő nagy sebességgel. így, egy része AX 1-2 UG elpusztult, 0, 1-0, 2 ms.
A kinetikája enzimes reakciókat. Minden kémiai reakció játszódik le egy bizonyos sebesség. Biológiai enzimek hozzárendelés küldi növelve a kémiai reakciók. Ezek a folyamatok tanul enzim kinetikát.
Enzim kinetikája - részén kémiai kinetika tanulmányozása a függőség a sebessége enzimes reakciók a kémiai jellegét a reaktánsok (szubsztrátok, enzimek) és a kölcsönhatás körülményei (koncentrációja a komponensek, pH, a táptalaj összetétele, a hőmérséklet, akció aktivátorok vagy inhibitorok, és mások.). Helyzete lehetővé teszi, hogy értékelje az enzimatikus folyamatban, és arra irányul, hogy befolyásolja a tanfolyamot. Nézzük laknak az alap.
Többféle típusú enzimatikus reakciók .. irreverzíbilis reakció egy szubsztrát, reverzibilis reakciót egy szubsztrát, irreverzíbilis reakció a két szubsztrát, stb A leggyakoribb irreverzíbilis reakció egy szubsztrát.
Az utóbbi esetben, az enzim E reagáltatunk először egy szubsztrát S, amely képződéséhez vezet az enzim-szubsztrát komplex ES (számos reakció -dvuh vagy több komplexek). Az enzim-szubsztrát komplex jellemző a képződés sebessége állandó a reakció k + 1, és a reakció állandó k-1 bomlási.
Az enzim-szubsztrát komplex jellemző a szubsztrátum állandó, vagy konstans Ks disszociációs.
A tápoldat mennyisége állandó természetétől függ a szubsztrátum és az enzim. Amikor ugyanazt a kezdeti koncentrációk az enzim és a szubsztrát koncentrációja a komplex [ES] lesz a nagyobb, minél kisebb az érték Ks.
Hordozóanyag állandó meghatározza a mértékét affinitása az enzim és a szubsztrát. Tehát, invertáz Ks = 0,0167. Ott fermentsubstratnogo komplex koncentrációja meghaladja a koncentráció a szabad enzim és a szubsztrát körülbelül 60-szor.
A második fázisban az enzimes katalízis egy enzim-szubsztrát komplex bomlik és E a enzimreakció terméket P.
Mindkét fázisában enzimes katalízis egyesítjük tipikus irreverzibilis reakciók egy szubsztrát:
A rendszer k + 2 van a bomlási sebességi állandója az enzim-szubsztrát komplex enzim és reakció-terméket P.
A teljes leírása az enzimatikus folyamat segítségével a Michaelis-állandó Km. Ez arányát fejezi ki a konstansok a három reakció a a rendszerben
Numerikus kifejezést Km mindig valamivel nagyobb, mint Ks. Így, Ks értéke az enzim-szubsztrát komplex szacharáz - szacharóz egyenlő 0,0167, és az értéket Cr - 0,0280 mol / l. Kt különböző enzimek változik.
Az arány a enzimes reakciók kifejezve a katolit (macska). Bowled - katalitikus aktivitását az enzim, amely képes végrehajtani a reakciót olyan sebességgel 1 mól / s, egy előre meghatározott rendszer aktivitás mérése. Catala -mikrokatali származékok gyakran használják (MAb), nanokatali (nkat) vagy pikokatali (pkat), amely megfelel a sebesség a reakciók kifejezve mikromól, és pikomól nanomól másodpercenként.
A sebessége enzimatikus reakció határozza meg a feltételeit annak előfordulása. Például, optimális körülmények között (teljes telítettség az enzim szubsztrát, a kívánt pH, hőmérséklet 25 ° C-on vagy 37), ez lesz a maximális vagy a kezdeti, és jelöljük V. Ez az arány jellemzi állandó bomlási sebességgel az enzim-szubsztrát komplex és az enzim koncentrációjától:
Az enzimatikus reakció, amely akkor következik be, ha nincs elegendő telítettsége az enzim szubsztrát, a megfigyelt arány jellemző # 957;. Ez határozza meg a termék a bomlás sebességi állandóját az enzim-szubsztrát komplex reakcióterméket alkot P és a koncentrációja az enzim-szubsztrát komplex:
Ha figyelembe vesszük, hogy
Így, az enzimatikus reakció sebessége egyenesen arányos a bomlási folyamat sebességi állandóját az enzim-szubsztrát komplex reakcióterméket alkot, a enzimszubsztrát koncentrációja és a szubsztrátum fordítottan arányos konstans.
Egy rögzített koncentrációjú lépést reakciók [ES] állandó. Ha a [S]> [E], majd a
Alkalmazása a Michaelis-állandó, az egyenlet egyszerűsíthető:
A megfigyelt reakciósebesség lehet alábbi egyenlet fejezi ki
Növelésével a szubsztrátum koncentrációja [S], ahol [S]> Km.
Itt, az enzimatikus reakció sebessége megközelíti a maximális. A reakció sebessége leírható az egyenlet a Michaelis - Menten:
A következő egyenletből következik, hogy az alacsony szubsztrátum koncentrációk az enzim reakció sebességét lineárisan függ [S], és nagyon magas szubsztrátum koncentrációk ez megközelíti a maximális sebesség Vm és már nem változik növekvő [S]. Az egyenlet is mutatja, hogy ha a
szint [S]> [E] A reakció sebessége arányos a koncentrációt az enzim E.