Protein elsődleges szerkezetét a fehérje, a formáció a tripeptid áramkör
Az elsődleges fehérjék szerkezete lineáris polipeptid lánc egymáshoz kapcsolt aminosavak peptidkötésekkel. Az elsődleges szerkezet - a legegyszerűbb szinten strukturális szervezet a fehérje molekula. Ez ad nagy stabilitás kovalens peptidkötések közötti # 945-amino-csoport, egy aminosav és # 945; karboxilcsoportja a másik aminosav
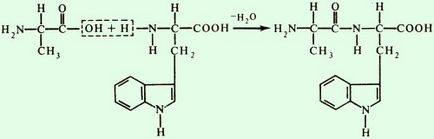
Ha a peptid-kötések részt imino prolin vagy hidroxi-prolin, hogy van egy másik megjelenés
A peptid-kötések a sejtekben kezdetben aktivált karboxilcsoportja egy aminosav, és akkor kapcsolódik az aminocsoporthoz egy másik. Rólunk végre laboratóriumi polipeptidek szintézise.
A peptid-kötés egy ismétlődő egység a polipeptid-lánc. Ez számos funkcióval, ami nemcsak az alakja az elsődleges szerkezet, hanem a magasabb szintű szervezet a polipeptid lánc:
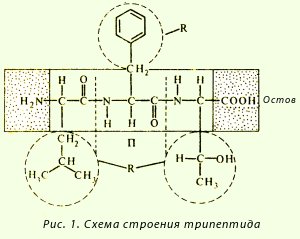
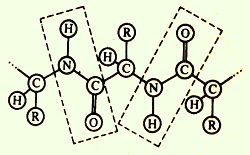
· Coplanarity - összes atomok tartoznak a peptid-csoport ugyanabban a síkban;
· Lehetőség létezik két rezonancia forma (keto- vagy enol-forma);
· Transz-helyzetben kapcsolódhat ahhoz a C szubsztituens-N-kötés;
· Az a képesség, hogy hidrogénkötéseket képeznek mindegyik peptid csoportokat képezhetnek két hidrogénkötéseket más csoportokkal, beleértve a peptidet.
A kivétel a peptid és az aminocsoport prolin vagy hidroxi-prolin. Képesek formában csak a hidrogén kötést (lásd. Fent). Ez befolyásolja a kialakulását fehérje másodlagos szerkezetét. A polipeptid-lánc olyan helyen, ahol a prolin vagy hidroxi-prolin, könnyen hajlítható, mivel nem marad vissza a szokásos módon, egy második hidrogénkötés.
formáció tripeptid rendszer:
Szintje térbeli elrendezése fehérjék másodlagos fehérjék szerkezete: a koncepció # 945; spirál és # 946; -skladchatom réteget. A harmadlagos szerkezete fehérjék: a koncepció a natív fehérje és fehérje denaturálódását. A negyedleges szerkezet a fehérjék egy példa a szerkezet a hemoglobin.
A másodlagos szerkezete a fehérje. Az másodlagos szerkezetét a fehérje polipeptidlánc kell érteni a módszer stack rendezett szerkezet. Szerint a konfiguráció az alábbi elemek a másodlagos szerkezet: # 945; hélix és # 946; -skladchaty réteget.
struktúra modellje # 945; hélix, amely figyelembe veszi az összes tulajdonságait a peptid kötést, már kifejlesztett L. Pauling és Robert Corey (1949-1951 gg.).
A 3. ábrán, vázlatos diagram # 945; spirál, amely képet ad az alapvető paramétereit. Polipeptidlánc dob egy # 945; helix úgy, hogy a spirális tekercsek rendszeres, tehát van egy spirális spirális alakkal szimmetria (ábra. 3b). Minden egyes körben # 945; 3,6 hélix aminosavak. A távolság a menetek, vagy a pályán a spirál 0,54 nm, a tekercs emelő szög 26 °. Kiépítése és fenntartása # 945; Ez akkor fordul elő helikális konfigurációt hidrogénkötések között képződött peptid csoportok minden n-edik és (n + 3) th aminosavat. Bár az energia a hidrogénkötések kicsi, nagy mennyiségű közülük vezet jelentős energia hatása, miáltal # 945; spirális konfiguráció meglehetősen stabil. Oldalcsoportok aminosavmaradékok fenntartásában szerepet nem játszó a # 945; helikális konfigurációt, ezért az összes aminosavat # 945; hélix egyenértékű.
A természetes fehérjék is léteznek csak pravozakruchennye # 945; spirál.
# 946; -Skladchaty réteg - a második elem a másodlagos szerkezet. különböző # 945; csigavonal # 946; -skladchaty réteg lineáris, és nem egy rúd alakú (ábra. 4). A lineáris szerkezetű által fenntartott termelő hidrogénkötések között peptid csoportok álló különböző részein a polipeptid lánc. Ezek a területek szorosan egymástól olyan távolságban, hogy egy hidrogénatom közötti kötés - C = O és HN - csoportok (0,272 nm).
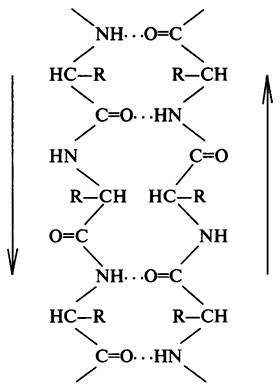
Ábra. 4. sematikus ábrázolása # 946; -skladchatogo réteget (nyilakkal jelzett
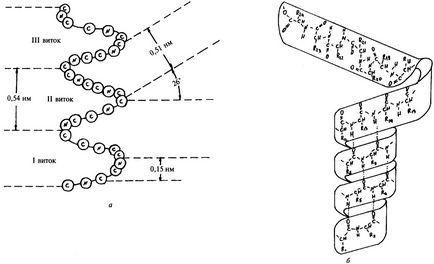
Ábra. Rendszer 3. (a) és a modell (b) # 945; csigavonal
A másodlagos szerkezet által meghatározott primer fehérje. Az aminosav maradékok különböző mértékben képes hidrogénkötések kialakítására, és ez befolyásolja a kialakulását # 945; csiga vagy # 946; típusú réteget. Azáltal spiraleobrazuyuschim aminosavak közé tartozik az alanin, glutaminsav, glutamin, leucin, lizin, metionin és a hisztidin. Ha a fehérje fragmens főleg az aminosav-maradékok a fent felsorolt, van kialakítva a helyszínen # 945; spirál. Valin, izoleucin, treonin, fenil-alanin, tirozin, és elősegíti a kialakulását # 946; -layers polipeptidlánc. Rendezetlen szerkezetek merülnek fel helyszínek a polipeptid-lánc, ahol az ilyen aminosav-maradékok koncentrálódnak, mint a glicin, szerin, aszparaginsav, aszparagin, prolin.
Sok fehérje ugyanakkor vannak # 945; spirál, és # 946; -fibers. Ratio spirális konfiguráció a különböző fehérjék különböznek. Tehát egy izomfehérje paramiozinhoz majdnem 100% spiralizált; nagy arányban helikális konfigurációt mioglobin és a hemoglobin (75%). Ezzel szemben, a tripszin, és ribonukleáz jelentős része a polipeptid-lánc illeszkedik a réteges # 946; szerkezetéből. Fehérjék rögzítő szövetek - keratin (haj fehérje), kollagén (a bőr fehérje és inak) - vannak # 946; -konfigurációjú polipeptid láncok.
A harmadlagos szerkezetét a fehérje. A harmadlagos szerkezetét a fehérje - ez a módszer a tojásrakás a polipeptid-lánc az űrben. A szerzett protein inherens funkcionális tulajdonságait, a polipeptid lánc dobni egy bizonyos módon a térben, amely egy funkcionálisan aktív szerkezetének. Egy ilyen szerkezet az úgynevezett bennszülött. Annak ellenére, hogy a nagyszámú elméletileg lehetséges, hogy egy polipeptid lánc térbeli minták fehérje feltekeredés képződéséhez vezet csak natív konfigurációjú.
Stabilizálás fehérje harmadlagos szerkezete között bekövetkező kölcsönhatás oldalán gyökök az aminosav-maradékok a különböző részein a polipeptid-lánc. Ezek a kölcsönhatások lehet osztani az erősségek és gyengeségek.
Az erős kölcsönhatások közé tartozik a kovalens kötések kénatomjai ciszteincsoportot, szemben különböző részein a polipeptid lánc. Egyébként az ilyen kapcsolatokat nevezzük diszulfid hidak; a kialakulását a diszulfidhíd lehet az alábbi képlettel ábrázolható:
Emellett kovalens kötés harmadlagos szerkezetét a fehérje molekula által fenntartott gyenge kölcsönhatások, amelyek viszont vannak osztva a poláros és nem poláros.
Poláros kölcsönhatásokhoz közé tartoznak az ionos és a hidrogén kötések. Ionos kölcsönhatások során képződnek kapcsolati pozitív töltésű oldalláncok csoportját a lizin, arginin, hisztidin és a negatív töltésű COOH csoportok aszparaginsav és glutaminsav. A hidrogénkötések között bekövetkező funkcionális oldalcsoportok aminosav csoportok.
Vagy nempoláros van der Waals kölcsönhatások aminosavai közötti szénhidrogéncsoport, hozzájárulnak a kialakulása egy hidrofób mag (zsírsav cseppek) belül a fehérje gömböcske, mint szénhidrogéncsoportok hajlamosak ne érintkezzen a vízzel. A több nem poláros aminosav-összetételét a fehérjék, a fő szerepet alakításában a tercier struktúráját játssza van der Waals kötések.
Többszörös közötti kapcsolatok oldalláncai aminosavak a fehérje határozza meg a térbeli konfigurációját a molekula (ábra. 5).
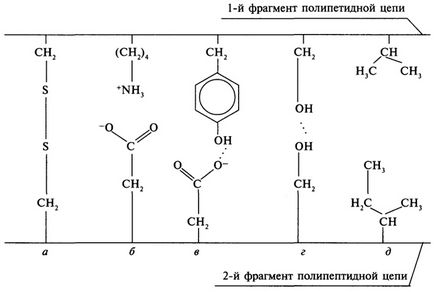
Ábra. 5. A típusú kapcsolatok, amelyek támogatják a harmadlagos szerkezetét a fehérje:
és - egy diszulfid híd; b - ionos kötés; c, d - hidrogénkötések;
d - a van der Waals-kapcsolat
A harmadlagos szerkezete a fehérje egyedi egyéni, mint egyedi és elsődleges szerkezete. Csak a megfelelő térbeli csomagolás a fehérje teszi aktív. Különböző zavarok a harmadlagos szerkezetét a fehérje eltérést eredményez a tulajdonságok és a biológiai aktivitás elvesztését.
Negyedidőszaki fehérje sturkture. Fehérjék, molekulatömege nagyobb, mint 100 kD 1 általában több polipeptid lánc viszonylag kis molekulatömegű. Szerkezet, amely több polipeptid-láncból elfoglaló szigorúan rögzített helyzetben egymáshoz képest, ahol a fehérje egy adott aktivitás, az úgynevezett kvaterner szerkezetét a fehérje. Egy fehérje, amely egy kvaterner szerkezetű, úgynevezett epimolekuloy ilimultimerom. és az azt alkotó polipeptid-láncból - rendre alegységei vagy promoterok. Egy jellemző tulajdonsága proteinek negyedleges szerkezet az, hogy egy külön alegység nem rendelkezik biológiai aktivitással.
Stabilizálása a kvaterner szerkezetét a fehérje miatt előfordul, hogy poláris kölcsönhatások oldalláncai között az aminosav-maradékok felszínén található az alegységek. Ezek a kölcsönhatások erősen tartsa alegységek szervezett komplex formájában. Rengeteg alegységek, amelyben kölcsönhatás alakul ki, az úgynevezett pad.
A klasszikus példa egy fehérje, amely egy kvaterner struktúra hemoglobin. A hemoglobin molekula molekulatömege 68.000 Igen négy alegységből két különböző típusú - # 945; és # 946; / # 945; Alegység áll 141 aminosav-maradék, egy # 946; - A 146. Felsőfokú sturkture # 945; - és # 946; hasonló alegységek, valamint a molekulatömegük (17000 Da). Mindegyik alegység tartalmaz egy prosztetikus csoport - hem. Mivel hem jelen van más fehérjék (citokrómok, mioglobin), amelyet további vizsgálatokat, legalábbis rövid időre megvitatják a szerkezet a menet (6.). Csoportosítás egy komplex hem koplanáris gyűrűs rendszer, amely egy központi atom képező koordinációs kötést négy pirrol molekularészek hidak kötik össze a metán (= CH -). A hemoglobin a vas általában az oxidációs állapotában lévő (2+).
Négy alegység - két # 945; és két # 946; - kombinálható egyetlen szerkezetet úgy, hogy a # 945; alegység érintkezésben csak a # 946; alegység és fordítva (ábra. 7).
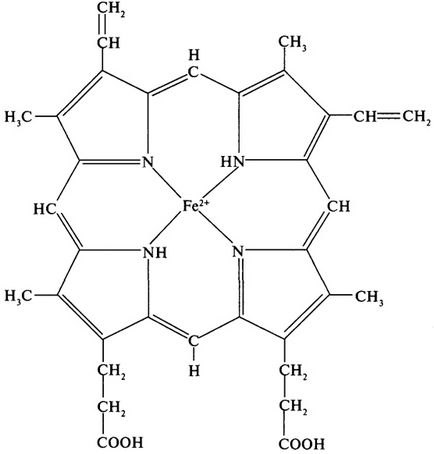
Ábra. 6. A szerkezet a hem a hemoglobin
Ábra. 7. sematikus ábrázolása a negyedleges szerkezet hemoglobin:
Fe - hem a hemoglobin
Amint a 7. ábrán látható, egy molekula a hemoglobin képes során négy molekula oxigén. És a kötődés és az oxigén felszabadulás kíséri konformációs változások a szerkezetben # 945; - és # 946; alegységek a hemoglobin és a relatív pozícióját epimolekule. Ez a tény azt jelzi, hogy a kvaterner szerkezetét a fehérje nem teljesen merev.