Személyes oldal - szerkezete, tulajdonságai és osztályozása fehérjék
Szerkezete, tulajdonságai, besorolása aminosavak
Tanulmányozása során a készítmény a fehérjék azt találtuk, hogy azok minden épült az elvnek az alapján, és négy szintje szervezet: elsődleges, másodlagos, harmadlagos, és néhány közülük, és negyedleges szerkezete túrák.
Az elsődleges szerkezet. Ez jelenti a lineáris láncú aminosavak elrendezve egy bizonyos sorrendben és egymáshoz peptidkötésekkel. Peptidnayasvyaz által alkotott α-karboxil-csoport, egy és meg aminokislo-α-amino-csoportját egy másik.
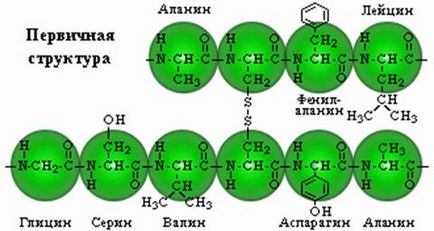
Aminosavak lehet kombinálni hosszú láncokba Zuy között képződött peptidkötés. Két aminosavak alkotnak egy dipeptid, ahol; Ha rá, hogy egy újabb, akkor nem volt-tripeptid, stb Peptidek, amelyek legfeljebb 10 aminosav elem az úgynevezett oligopeptidek, és legfeljebb 50 -polipeptidami. Po lipeptidy amelyek több mint 50 aminosav, a fehérjék már említett, bár ezt a nevet használjuk, amelyek több mint 100 aminosavat több vegyületet.
Az aminosav egységek, amelyek részei a peptid általában úgynevezett aminosavmaradékok. Ezek már nem aminosavak, mint eredményeként a peptidkötések kialakításának mindegyikük hiányzik egy hidrogénatom a-aminocsoportot és egy hidroxil anion karboxil. Az aminosav-maradék található a terminális a peptid, ahol van egy szabad α-amino-csoport, az úgynevezett az amino- vagy N - terminális maradék; a maradékot a szemközti con-ce molekulát tartalmaz szabad karboxilcsoportot - a karboxi-terminális vagy C-terminális. Naz, rendelkezésre álló létrehozott peptideket, a nevét az azokat alkotó aminosavak aszerint, hogy azok szekvencia kiindulási anyagok: N-terminális.
A másodlagos szerkezet. Ez jelenti, vagy - a megrendelt és kompakt csomagolás a polipeptid lánc. Szerint a konfiguráció, ez a spirál alakban és raktár chatoy szerkezetét.
Az alapot a α-hélix tidnaya NEN-lánc és az aminosav gyököket kifelé irányuló, hogy található a spirál. Külsőleg, az α-hélix olyan, mint egy kicsit megnyúlik tekercs elektromos. Egy ilyen alak jellemző fehérjék, amelyek egy polipeptid-láncot (albumin, globulin, stb).
Skladchatayaβ szerkezet jelentése SVOCs kuyu-alakú, és hasonló a harmonika szőrme. Ez hektárnál acteristic rendelkező proteineket több polipeptid-TION áramkörök párhuzamosan elrendezett, β-szerkezet található fehérjék, mint például a tripszin, ribonukleáz, haj keratin, a kollagén inak.
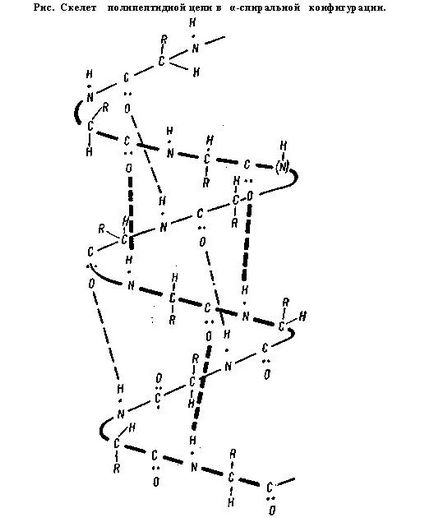
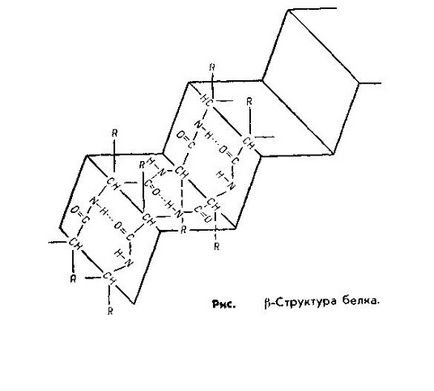
A formáció a másodlagos szerkezet által biztosított hidrogénkötés. Ez van kialakítva részvételével hidrogénatom található két silnootritsatelnymi atomok amelyek közül az egyik egy (a-pocakos) nagyobb az affinitása.
A hidrogén kötés gyenge, könnyen Obra-zuetsya és könnyen törik. A fehérje molekula ilyen típusú kommunikáció között van kialakítva α-hidrogén az amincsoport egy peptidkötés oxigén és β-karboxilcsoportja a másik.
A α-hélix által alkotott hidrogénkötéssel úgy, hogy minden NH csoportot a peptid kötés van csatlakoztatva a negyedik bank a lánc mentén CO-csoport más kommunikációs. Ez az connect-NIJ biztosítani helix lánc. A szerkezet a β-hidrogén kötés Obra-zuetsya közötti azonos csoportban pirovkami-de-vezetőképes tartozó NYM különböző polipeptid-lánc. Így, az összes CO- és NH-csoportok, poli-kifejtő peptid láncok vannak összekapcsolva, hidrogénkötések-küzdelemben.
A harmadlagos szerkezet. Miután a harmadlagos szerkezete kerek-fehérje molekula sokkal kompaktabb térbeli elrendezése Noe polipep tidnoy-lánc, vagy inkább annak Auto-ed rendű struktúrát. Az alakja a harmadlagos szerkezet nagyon eltérő lehet és úgy határozzuk meg, az a tény, hogy a különböző funkcionális csoportok a polipeptid lánc képezhet különböző típusú kötések (elektrosztatikus, ionos, van der Waals erő, stb ..).
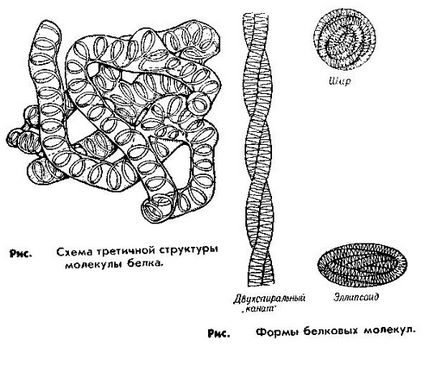
Ez a szerkezet elég merev ahhoz, hogy a Obus gyönyörködtető jelenlétében diszulfid (- S. S-) kötések (diszulfid hidak), amelyek között vannak kialakítva kénatomjai két molekula cisztein-helyen konjugált különböző helyeire a polipeptid lánc.
Ez biztosítja a harmadlagos szerkezetét a fehérje és a fő funkciói függően ez a harmadlagos szerkezet, vagy lehetnek bolus (gömböcskéket) globuláris fehérjék, vagy, és a szálak (fibrillák) fibrilláris proteinek. Globuláris fehérjék a vérben, és sok szervet. Képviselőik albumin és globulin. Fibrilláris proteinek alapját képezik az izomszövet.
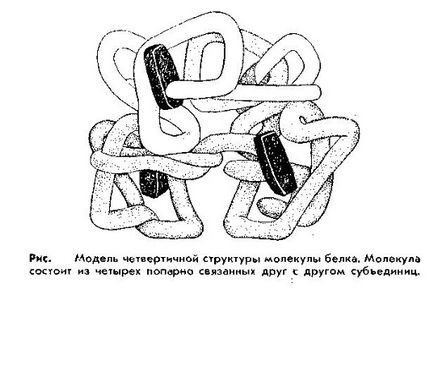
A negyedleges szerkezet. A szervezetben, több komplex szerkezetűnek fehérjék álló több úgynevezett alegységek. amelyek mindegyike egy fehérje molekula és specifikus struktúrát, akár tercier. Az ilyen társulása alegységek úgynevezett kvaterner szerkezetét. Speciális-Ness a kvaterner fehérjék szerkezete azon képességük, hogy gyakorolja funkcióját és tulajdonságait csak jelenlétében összes alegységét. Eltávolítása legalább egyikük elvesztéséhez vezet funkciót. Az egy Kim proteinek közé tartozik a hemoglobin, enzimek és számos más.
így kvaterner struktúrát megérteni a fehérjék szerkezete, amely több polipeptid láncok. Mindegyik lánc befejezte a háromdimenziós szerkezet a fehérje-alegységet nevű kvaterner szerkezetét.
Fehérjéknek nagy molekulatömegű szol-Reams vízben, a duzzadásra képes jellemzi reaktivitás, a mobilitás egy elektromos mező és néhány egyéb tulajdonságait. Fehérjék aktívan lép kémiai reakciókat. Ez a tulajdonság annak köszönhető, hogy az a tény, hogy az aminosavak alkotó fehérjék tartalmaznak különböző funkciós csoportokat, amelyek képesek reakcióba lépni más anyagokkal. Fontos, hogy az ilyen kölcsönhatások fordulnak elő a fehérjemolekula, kialakulását eredményezi a peptid, a hidrogén, és más típusú diszulfidkötések. Amino- gyökök, és következésképpen, a fehérjék csatlakozhat a különböző vegyületek és ionok, amely lehetővé teszi a szállítás a vér.
1. A fehérjék nagy molekulatömegű-csatlakoztatott niyami. Ez a polimerek, amelyek több száz vagy több ezer monomerek - aminosavak. Ennek megfelelően, a molekulatömege a protein közötti tartományban van 10000 1000000 Így részeként ribonukleáz (egy enzim, amely hasítja az RNS) tartalmaz 124 aminosavat, és molekulatömege körülbelül 14000 mioglobin (izomfehérje) tagjai a 153 aminosavból, amelynek-an molekulatömege 17000, és a hemoglobin - 64500 (574 aminosav). A molekulatömege más fehérjék magasabb: γ _ globulin (ob antitest képez) áll 1250 aminosavból áll, és molekulatömege körülbelül 150000, és a molekulatömeg meghaladja 1.000.000 glutamát-dehidrogenáz enzimet.
A molekulatömeg-meghatározást végzünk egyszer vagy különböző módszerekkel :. ozmométer, gélszűrés, optikai, stb azonban a legpontosabb a szedimentációs eljárás által javasolt T. Svedberg. Ez azon a tényen alapul, hogy ultracentrifugálással a 900000 g gyorsulás akár a sebesség lerakódását fehérjék függ a molekulatömegük.
2. A legfontosabb tulajdonsága fehérjék felé mutat-ség a savas és bázikus tulajdonságúak, azaz a. E. törvény amfoter elektrolitok. Ez úgy valósul meg a különböző disszociáió csoportot tartalmazza az aminosav-gyökök.
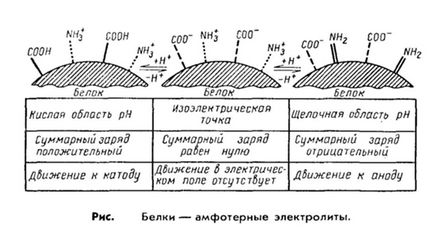
Például, a savas tulajdonságait a fehérje mellékelt karboxilcsoportjai aszparaginsav és glutaminsav aminosavakkal, és alkáli - gyökök arginin, lizin és hisztidin. Minél több amino-dikarbonsavak foglalt protein, annál kifejezettebb a savas tulajdonságokkal és a forgalom.
Ugyanezek a csoportok is elektromos töltések. amelyek a teljes töltés mol fehérje-Kula. A fehérjék, domináló aszparaginsav és glutaminsav aminosavakkal, protein-töltés lesz a-negatív, a feleslegben lévő bázikus aminosavak kapcsolódnak a pozitív töltését a fehérje molekula. Következésképpen, a villamos térerősség a fehérjék lesz elmozdulni a katód vagy az anód értékétől függően a teljes töltés. Így, lúgos közegben (pH 7 - 14) küld egy proton fehérjét és negatív töltésű, míg savas közegben (pH = 1-7) elnyomja a disszociációs a savcsoportok és a protein válik kation.
Így a meghatározója a viselkedését a fehérje egy kation vagy anion, a reakcióközeget, amely által meghatározott a hidrogénionok koncentrációját, és van kifejezve a pH. Alapján azonban bizonyos pH számú pozitív és negatív töltések kiegyenlített, és a molekula válik elektromosan. t. e. hogy nem mozdul egy elektromos mező. Az ilyen pH-érték meghatározására, mint az izoelektromos pontja fehérjék. Ha ez a fehérje a legkevésbé chivom felfekvő állapotban, valamint kis változások a pH értéke a savas vagy lúgos oldalán könnyen kicsaphatjuk. A legtöbb természetes fehérjék izo-elektromos pontja található, egy gyengén savas közegben (pH = 4,8-5,4). ami azt jelzi, az uralkodó dikarbopovyh savak.
amfoter tulajdonságokkal az alapja a puffer tulajdonságai fehérjék és részvételét a szabályozásában vér pH. Amfoter fehérjét használnak, hogy külön őket frakciók, például elektroforézissel, annak érdekében, hogy diagnosztizálni számos betegség és ellenőrzése a beteg állapota, mivel a különböző patológiás-cal körülmények frakcionált összetétele fehérjék sous-szignifikáns, változásokat.
3. fontossága a test egy fehérjét Az a képesség, hogy adszorbeálja nekoto rozs anyagok és ionok (hormonok, vitaminok, vas, réz, stb), amelyek vagy rosszul oldódnak vízben vagy toxikus (bilirubin, szabad zsírsavak) . A fehérjéket szállítják a vér a helyszínek a további reakciókhoz, vagy ártalmatlanok-Bani.
4. Vizes oldata fehérjék megvannak a saját jellegzetességei. Először, a fehérjék nagy affinitással a víz, azaz a. E., Ezek hidrofil. Ez azt jelenti, hogy egy fehérje molekula, mint a töltött részecskék vonzza a vizet dipólusok, amelyek körül vannak elrendezve a fehérje molekulák és így egy vizes vagy hidratációs héj. Ez héj megvédi a fehérjét molekulák kötési és a csapadék.
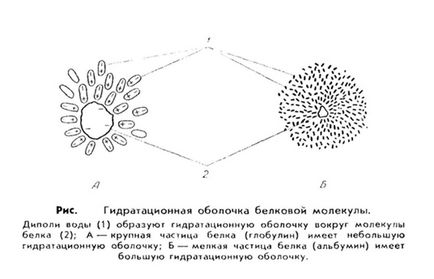
Az érték függ a hidratációs héj a fehérje szerkezetét. Például, albuminok könnyebben kötődnek Xia a vízmolekulák és viszonylag fájdalom Shui vizes shell, míg a globulinok. Rostos Nogent csatolt rosszabb a víz és a hidrát burok azok kevesebb.
Így a vizes fehérjeoldatot stabilitást két tényező határozza meg. on-lichiem elektromos töltése fehérjemolekula található szerte a hidratálást héj. Ha törli ezeket a tényezőket fehérje kicsapódik. Ez a folyamat lehet reverzibilis és irreverzibilis.
Váltvaforgató fehérjekicsapássai (vysali- vshie) magában foglalja az fehérjekicsapódás hatására egyes anyagok eltávolítását követően, ahol X, ismét visszatér az eredeti (natív) állapotban van. Kisózás fehérjék használják az alkáli- és alkáliföldfémek (leggyakrabban használt a gyakorlatban a nátrium-szulfát és ammónium). Ezeket a sókat eltávolítjuk vízköpeny (ok dehidráció), és távolítsa el a töltést. Összege közötti hidratációs héj fehérje molekulák és tömény atsiey sók közvetlen kapcsolat létezik: a kisebb hidrát burok, a kevesebb só szükséges. Így, globulinok, amelyek a nehéz és a nagy és kis molekulák a hidratációs héj csapadékot hiányos telítési sók oldat és albuminok, mint a kisebb molekulák körül nagy víz shell, - teljes telítettséget.
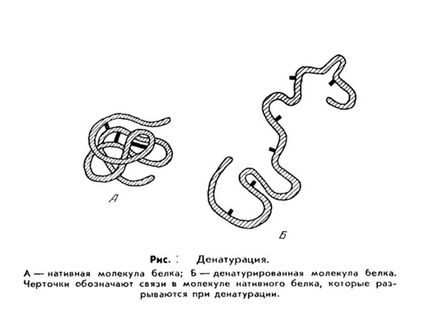
Irreverzibilis lerakódás járó mélyreható változásokat a intramolekuláris a fehérje szerkezetének, így a veszteség a saját natív tulajdonságok (oldhatóság, biológiai aktivitás, stb). Ez a fehérje az úgynevezett denaturált. és a folyamat - denaturáló.
Denaturálása a fehérjék (a latin de- - prefix jelenti, hogy a szétválasztás, eltávolítás és lat természet - jellege; .. Nem tévesztendő össze egy páncél denaturatus - mentes a természetes tulajdonságait.) - A kifejezés Biological Chemistry, ami azt jelenti, elvesztése fehérjék a természetes tulajdonságok (oldhatóság, hidrofilitás, stb .) megsértése miatt a térbeli szerkezet a molekulák.
A folyamat a denaturációs külön fehérjemolekulák, ami a széteséséhez „merev” három-dimenziós szerkezet, néha nevezik fúziós molekula.
Gyakorlatilag bármilyen észrevehető változást a külső körülmények, például melegítéssel vagy savas kezeléssel a fehérje vezet zavar a soros kvaterner, tercier és szekunder fehérje szerkezetek. Jellemzően, denaturáció által okozott hőmérséklet-emelkedést, a fellépés erős savak és lúgok, nehézfémek, bizonyos oldószerek (alkohol), a sugárzás és mások.
Denaturáló gyakran vezet az a tény, hogy a kolloid oldat a fehérje molekulák történik fehérje részecskék aggregálódnak nagyobb folyamat. Vizuálisan úgy néz ki, mint például, a formáció a „fehérje”, amikor a sütés tojás.
Fehérjék denaturálása zajlik a gyomorban, ahol van egy erősen savas (pH = 0.5 - 1.5), és ez elősegíti a hasítást a proteolitikus enzimek, fehérjék.
Fehérjék denaturálása, mint az alapját kezelésére mérgezés tyazhe-lymi fémek, amikor a betegnek per os mo-loco vagy nyers tojást annak érdekében, hogy a fémek, denaturációs-riruya tejfehérjét és tojás, adszorbeálva a felületükön, és nem volt hatása a gyomor nyálkahártya fehérjék és bél, valamint a nem-szívó Valis a vérben.
Renaturálása (kisózás) - fordított folyamat denaturálás mely fehérjék visszanyerik természetes szerkezetét. Meg kell jegyezni, hogy nem minden a fehérjék képesek renaturáljuk; A legtöbb, fehérjedenaturációja visszafordíthatatlan.