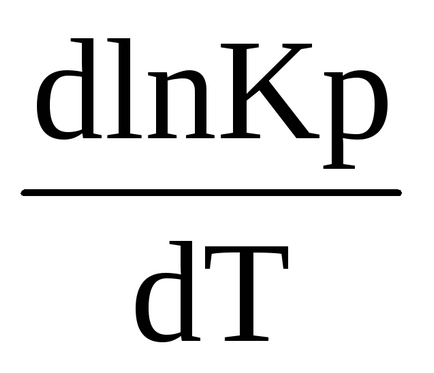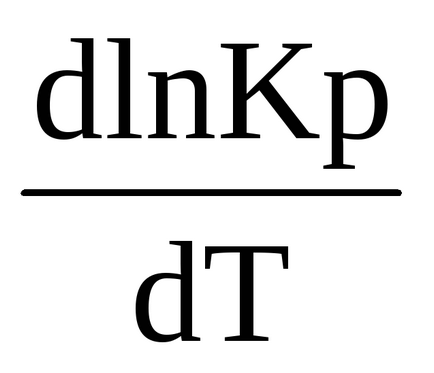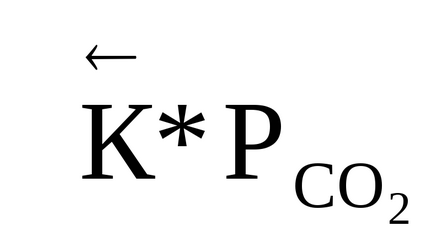0 (t) <0, в правой части выражения (1.90) R> 0, T> 0, ezért az első derivált a logaritmusa egyensúlyi állandó hőmérséklet negatív
<0, т.е. ln Kp (и сама константа Кр) являются убывающими функциями температуры. При увеличении температуры константа химического равновесия (Кр) уменьшается и что согласно закону действующих масс (2.27), (2.28)соответствует смещению химического равновесия в сторону обратной (эндотермической) реакции. Именно в этом проявляется противодействие системы оказанному воздействию.
Az endoterm folyamat Δr H 0 (t)> 0, a származékot a logaritmusa egyensúlyi állandó hőmérséklet pozitív (
> 0), a tárgy módon ln Kp és KR növekszik funkciói a hőmérséklet, azaz a összhangban a tömeghatás törvénye a hőmérséklet növekedésével az egyensúlyi eltolódások irányában az egyenes vonal (endoterm reakció). Azonban nem szabad elfelejtenünk, hogy a sebesség mind izoterm és endoterm folyamatok együtt növekszik a hőmérséklet és együtt csökken, de a változás sebessége
és
hőmérséklet-változás másképp, azonban a hőmérséklet változtatásával, eltolódhat az egyensúly a kívánt irányba. egyensúlyi eltolódás okozta koncentrációjának megváltozását egyik komponense: hozzátéve az anyag egy egyensúlyi vagy kimenetét a rendszer.
Szerint a Le Chatelier-elv koncentrációjának változtatásával az egyik résztvevő az egyensúlyi eltolódások irányába kompenzáló változások a reakcióban, azaz, koncentrációjának növelésével az egyik a kiindulási anyagok - a jobb oldalon, miközben növeli a koncentrációja a reakció egyik termékek - a bal oldalon. Ha a reverzibilis reakciót magában foglaló gáz halmazállapotú anyagok, a változó a nyomás, egyformán és egyszerre változtatni minden a koncentráció. És a változó sebességű folyamatok, ezért előfordulhat, és elmozdulás a kémiai egyensúly. Például, a nyomás növekedését (szemben az egyensúlyi) a CaCO3 rendszer (K)
CO (k) növeli a fordított reakció sebességét + CO2 (g)
=
ami vezet egy eltolja az egyensúlyt a bal oldalon. A nyomás csökkentésével a rendszerben szűkebb fordított reakció sebességét csökkenti, és az egyensúlyi jobbra tolódik. Növelésével a nyomás a rendszerben 2HCI
H2 + Cl2. amely egyensúlyi állapotban, az egyensúly eltolása nem fordulhat elő, mert mindkét sebesség
és
növelése egyaránt.
A rendszer 4HCl + O2
2Cl2 + 2H2 O (g) a nyomás növelése növeli a sebességét az előre reakció és az egyensúlyi jobbratolódást.
És így, összhangban a Le Chatelier elve, ha a nyomás növekszik, eltolódik az egyensúly kialakulását a kisebb mólszáma gáznemű anyagok a gázkeverék és így csökkentik a rendszer nyomását.
Ugyanakkor, ha a külső hatás, ami nyomásesést, eltolódik az egyensúly kialakulását nagyobb számú mól gáz halmazállapotú anyagok okoznak növekedését nyomás a rendszerben, és ellenállnak által kiváltott hatások.
Chatelier elv nagy gyakorlati jelentősége van. Ennek alapján tudjuk választani a feltételeit kémiai kölcsönhatások, amelyek a maximális hozama a reakció termékek.
Kapcsolódó cikkek