atomfizika
Elemei kvantumfizika az atomok és molekulák
Elmélet hidrogénatom Bohr
§1 Model atom Thomson és Rutherford
A tanítás az atomi anyag szerkezetének keletkezett a régi időkben. Azonban a végén a XIX században az atom oszthatatlan elemi alapelv ( „tégla”) olyan anyag.
A közepén a XIX században, kísérletileg bizonyított, hogy az elektron az egyik fő összetevője minden anyag. (1749-ben Benjamin Franklin feltételezték, hogy a villamos energia egyfajta anyagi szubsztancia központi szerepét elektromos számít, ő rendelt képviselete atomi szerkezetének az elektromos folyadék a munkálatok Franklin először feltételek: .. Charge, folyás, pozitív töltés, negatív töltés, egy kondenzátor akkumulátor villamosenergia-részecskéket.
Johann Ritter 1801 javasolt diszkrét, szemcsés szerkezete villamosenergia.
Wilhelm Weber művében, hiszen 1846 bevezeti a villamos energia és atomi hipotézist, hogy a mozgás a mag körül anyaga lehet magyarázni a hő és fény jelenségek.
- 1905-ben, JA. J. Thomson (Lord Kelvin) javasolták első atomi modellt amely szerint atom folyamatosan töltődik pozitív töltéssel labdát sugarú
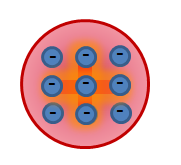
10 -10 m, amelyben körülbelül egyensúlyi helyzetben változhat elektronokat. A teljes negatív töltés a elektronok egyenlő a pozitív töltésének a labdát, így összességében semleges atom (atom Thomson modell úgynevezett „mazsola zsemle” vagy „mazsola puding”).
- Modell Rutherford atom
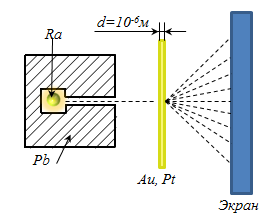
Rutherford 1909-ben végzett kísérleteket a folyosón a α - részecskék révén vékony fémlemezek arany és platina. (Α-részecskék fordulhat elő, ha a radioaktív transzformációk töltése α - részecskék két elektron díjak :. Qα = 2 e = 2 × 1,6 × 10 -19 tömeg Cl négy proton tömegek mα = 4 MP = 4 · 1,67 · .. 10 -27 kg). α - által kibocsátott részecskék rádium, helyezni az üreg a vezető csatorna úgy, hogy valamennyi mozgó részecskék a csatorna hosszában mellett, felszívódik ólom. Egy keskeny sugár esett egy aranyfóliára merőleges felületére. α - részecskék miután áthaladt a fólia és szétszórt flash-általa okozott (szcintillációs) egy fluoreszkáló képernyőn.
Hátrányai a modell a Rutherford:
a) Az elektronok az atom modell nem lehet rögzíteni, mert hatása alatt a Coulomb-erő, akkor vonzott (és ez „esik”), hogy a mag. Ebben a modellben, végtelen sok értéket sugarak az elektron kering és a megfelelő sebességgel
Ez azt jelenti, hogy a tartomány és a sebesség folyamatosan változtatható. Ennélfogva, bármely része lehet energiát bocsátanak ki, és így, a spektrum egy atom kell folyamatosnak lennie. Sőt, a tapasztalat azt mutatja, hogy az atomoknak van egy vonal spektrumot.
b) ha R ≈10 -10 m v ≈ 10 6 m / s és szerinti elektrodinamikában, mozgó elektronok a gyorsulás elektromágneses hullámokat sugároznak, és ezért folyamatosan energiát veszítenek. Ezután, az elektron fog spirál közelebb a mag, és ezen keresztül τ ≈ 10 -10 esik rajta. Másrészt, a sugárzási frekvenciát kell folyamatosan változik változása miatt r, v, T. Következésképpen, az atom ad folytonos spektrumú.
Kísérletet tesz egy atom modell a klasszikus mechanika törvényei, a villamos energia és optika vezettek ellentmondás a kísérleti adatokkal:
modell - a) a bizonytalanság a atom; b) egy folytonos spektrum;
Kísérlet - a) stabil atom; b) bocsát ki bizonyos feltételek mellett; c) Line Spectrum.
§2 vonal spektrumát hidrogénatom.
Formula Balmer - Rydberg
Izzó gázok így Line Spectrum kibocsátási, álló egyes spektrális vonalak. Amikor a fény áthalad gázok abszorpciós spektrumok uralkodott - minden egyes atom elnyeli azokat a spektrális vonalak, amely maga is bocsátanak ki.
Spectrum - egy sor harmonikus összetevők vagy hullámhosszon. Például, ha a hullám is képviselteti magát a szuperpozíció két hullám frekvenciákkal ω1 és ω2. akkor azt mondjuk, hogy a spektrum két összetevőből áll, vagy két sor λ1 és λ2. A spektrumok:
a) uralkodott - az atomok és a molekulák egyszerű kibocsátott gázok; csíkos - - komplex molekulák; szilárd - melegítjük szilárd anyagok és folyadékok;
b) ispuskaniya- alatti elektromos gázkisülési melegítése közben a szilárd anyagok, stb.; abszorpciós - fény átmegy gázok, folyadékok és szilárd anyagok, és ahol minden egyes atom elnyeli azokat a spektrális vonalak, amelyek maga bocsát ki;
c) diszperziós (prizmás) - nyert bomlása fehér fényt a prizma; A diffrakció - bomlása által egy diffrakciós rács;
d) atomi - spektruma az atomok (például mentesítés gázokat); molekuláris (csíkos) - rendelkezik a szalagok formájában képződött szorosan egymás színképvonalai
1) rezgési -> DIC (infravörös λ = 0,1 ÷ 1 mm);
2) forgási -> IR λ = 1 ÷ 10 mikron;
3) elektron - rezgési (látható és UV hullámhosszúságú λ = 0,3 mikron és a fenti);
Az első spektrumú vizsgáltuk nagyon egyszerű elemek - hidrogénatom. Balmer 1885-ben, létrehoz egy, hogy az ismert hullámhosszú míg kilenc hidrogén spektrális vonalakat lehet képlettel számítottuk ki
J. Rydberg (svéd tudós) felajánlott egy másik jelölést
- képletű Balmer - Rydberg.
R '= 10973731 m -1 - Rydberg állandó (R' = 1,1 · július 10 m -1)
mert Akkor tudjuk írni
ahol R = R'c = 3,29 · október 15 c -1 - ugyanazon Rydberg állandó.
Formula Balmer - Rydberg első rámutatott különleges szerepét az egész számok a spektrális törvényeket.
Ma már ismert, nagy számú színképvonalak hidrogén, amelyek hullámhossza nagy pontossággal kielégítik a képlet Balmer - Rydberg. Általános képlet Balmer - Rydberg látható, hogy a spektrális vonalak, különböző értékeivel jellemzett n. csoportot alkotnak, vagy sorokat, az úgynevezett Balmer sorozat. N növelésével spektrális sorozat sorban egymáshoz közeledik.
Balmer sorozat a látható része a spektrum, így fedezték fel először.
Elején a XX század spektrumában a hidrogénatom azt találtuk még néhány fut a láthatatlan része a spektrum.
Így a következő sorozat ismert spektrumú a hidrogénatom