Vizes oldatok az elektrolitok
Az elektrolitok olyan anyagok, amelyek egy olvadt vagy oldott vezeti az áramot.
Ő fejlesztette ki a elektrolitos disszociáció elméletének Svante Arrhenius. Azt javasolta egy elmélet megmagyarázni a viselkedését és tulajdonságait sok elektrolit.
Az elmélet szerint az elektrolit molekulák vízben vagy más közegben, azzal jellemezve, hogy a nagy dielektromos állandó *, disszociál ionokra - pozitív (kation) és negatív (anion).
A folyamat a felbomlása számít ionokra nevezzük elektrolitos disszociáció. A gyenge elektrolitok, bevételt reverzibilisen ki, és az alábbi közelítő egyenlet
Azáltal elektrolitok közé tartoznak azok a molekulák, amelyekben az atomok kötött erősen poláros vagy ionos kémiai kötéseket.
Szerint a modern koncepciók elektrolitos disszociáció oldatban annak az eredménye, komplex fizikai-kémiai kölcsönhatásuk poláris molekulái az elektrolit oldószer-molekulákat.
A kölcsönhatás az ionok a poláros oldószer-molekulákat nevezik szolvatáció (vizes oldatok esetében - hidratáció) ionok. A szolvatáció képződéséhez vezet az összefüggéseket az oldat ionokat (kationok és anionok) és az oldószer-molekulák. A folyamat a feloldjuk az anyag a K + A- vízben, amely egy tipikus vegyület ionos kötést, felírható a következőképpen:
.
szilárd habarcs
Egy elektrolitos disszociáció poláris molekulák (KA) kommunikáció miatt csillapítása az oldatban tevékenysége által okozott poláris oldószer-molekulák:
KA + xH2O <=> K + (H2O), hogy A + (H2O) a.
Egyesület K + (H 2 O) k és az A- (H2O), és hidratált kationok és anionok.
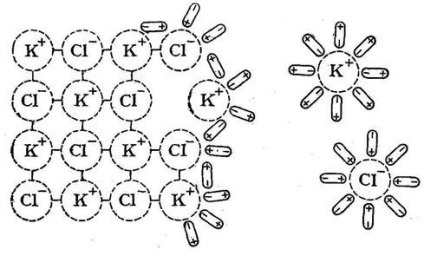
Ugyanilyen fontos a dielektromos állandója az oldószer: minél nagyobb az utolsó, annál nagyobb a gyengített közötti kapcsolatot az elektrolit ionok. Ez következik a képlet Coulomb-törvény
, ahol F - az erő között a díjak L1 és L2, r a központjai közötti távolság az ionok, # 949; - a dielektromos állandója az oldószer. A víz 20 ° # 949; = 80, hogy az az erő, a vonzás az ionok a vizes oldatban csökken 80-szor.
Ha az oldat további felmerülő is hidrogénkötések között oldószer molekulák és a hidrogénatom egy oldott anyag, a disszociációs folyamat lezajlik hatékonyabban.
Abból a szempontból elektrolitikus disszociáció úgynevezett savas vegyület disszociál vizes oldatban képeznek egy hidratált hidrogénion (hidróniumionok), és a sav molekularész:
,
ahol H3O + - hidrónium ionok.
Minden általános tulajdonságok savak (savas íz képes változtatni színét mutató, stb) tartozik hidroxóniumion ion.
Az ok az úgynevezett vegyületet disszociál vizes oldatban és így negatív hidroxid ionok Oh-:
MeOH + xH2O <=> Me + (H 2 O) k + OH- + (X-k) H 2O
ahol Me + - egy vegyértékű kation.
Minden általános tulajdonságok oldható bázis (lúgos szappan íze, képes megváltoztatni a specifikus elszíneződés mutatók, stb) tartozik egy hidroxidion.
Abból a szempontból az elektrolitikus disszociáció a só lehet tekinteni, mint a termék a reakció a sav és a bázis:
X (sav) + y (bázis) → só + víz,
ahol x és y - változó számú ekvivalens kölcsönható savak és bázisok.
Attól függően, hogy az arány a x és y a következő típusú sók disszociál vizes oldatok séma szerint:
ha x> y - savas sók
2H2SO4 + Mg (OH) 2 ® Mg (HSO4) 2 + 2H2O;
Mg (HSO4) 2 <=> Mg2 + + 2HSO4-;
ha x = y - átlagos (normális) só
H2SO4 + Mg (OH) 2 ® MgSO 4 + 2H2O;
MgSO4 <=> Mg2 + + SO42;
x <у – основные соли
H2SO4 + 2 Mg (OH) 2 ® (MgOH) 2SO4 + 2H2O;
(MgOH) 2SO4 <=> 2MgOH + + SO42;
Általános szabály, hogy az összes só erős elektrolitok.
Erős elektrolitok teljesen disszociált vizes oldatokban.
A víz az oldószer, a statisztikailag egyenletesen elosztott teljesen hidratált kationok és anionok egy erős elektrolit. Elektrosztatikus kölcsönhatás az ionok a minimumra csökken a nagy távolságok között, és a hidratálás shell teljesítő árnyékoló szerepet.
Ezzel szemben az erős elektrolitok disszociációját gyenge elektrolitok bekövetkezik reverzibilisen és egyensúly jön létre.
Mennyiségileg disszociációs folyamat leírható a következő értékeket: fokú elektrolitikus disszociációja, elektrolitikus disszociációs konstans K et al.
A mértéke elektrolitikus disszociációja - az aránya molekulák bomlott ionok, az összes oldott anyag molekulák oldatban.
egy mérhető frakcióinak egy egység vagy százalékban. a = 0, ha a disszociációs nincs jelen; a = 1, vagy a = 100% teljes disszociációja az elektrolit.
Szerinti eljárással elektrolitos disszociáció, mint egy reverzibilis folyamat, lehetőség van elvét alkalmazni a Le Chatelier és azonosítani a befolyása a külső tényezők az egyensúlyi állapotban, amely megváltoztatja az értéket a.
A elmozdulása egyensúlyi
K + A + xH2O <=> K + (H 2 O) k + A (H2O), és
balról jobbra, azaz abba az irányba, disszociáció, szükség van, hogy növelje a súlyát az oldószert. Ez azt jelenti, hogy:
disszociációja gyenge elektrolitok kiterjed hatékonyan híg, mint a koncentrált. Más szavakkal, egy csökkenésével növekszik elektrolit koncentrációja az oldatban, és azon a maximális értéke a = 1 egy végtelenül hígított oldatot.
mivel disszociációs endoterm folyamat, a disszociációs mértéke gyenge elektrolit a vizes oldat a hőmérséklet növekedésével nő.
Elektrolitikus disszociációs állandója K egy konstans, a kémiai egyensúly az elektrolit oldat:
,
ahol [K +], [A-] és [KA] - ion koncentrációja az oldatban
(Gram-ion / liter) és az SC disszociálatlan vegyületek (mol / l).
A több, annál jobb az elektrolit bomlik le ionokra. Egy adott elektrolit állandó értéket K egy bizonyos hőmérséklet, és ellentétben egy független a koncentrációtól.
Közötti kommunikáció állandó K és disszociációfok megtalálható a következő. ion koncentrációja K + és A- oldatban egyenlő
ahol a C - a kezdeti moláris koncentrációja; egy - fokú elektrolitos disszociáció az elektrolit. Koncentráció SC disszociálatlan molekulák oldatban egyenlő
.
Ez az egyenlet fejezi ki a törvény a hígítás.
Ha egy kicsi, akkor egy 1- ≈ 1, majd
.
Látható, hogy a csökkenő elektrolit koncentrációja az oldatban növeli a mértékét elektrolitos disszociáció.
Disszociációja a gyenge elektrolit, amelyek molekulája nem disszociál két, és nagyobb számú ionok (elektrolitok heterovalent ionok) fordul elő szakaszokban (lépésben disszociációs). Például, ha a gyenge szénsav H2CO3 disszociációs vizes oldatban van, a következő egyensúlyi helyzet:
I. lépés: H2CO3 <=> H + + HCO 3
.
Lépés: HCO 3 <=> H + + SO32
.
Amint látható ezek az adatok, egy gyenge elektrolit disszociációs folyamat heterovalent ionok elsősorban meghatározott első szakaszban.
Tegyük fel például, elektrolitikus disszociációs állandók bizonyos gyenge savak és bázisok (25 ° C):
Reakciók az elektrolit oldatok, amelyekben nem történik változás a felelős a ionok szereplő vegyületek említett ioncserélő reakciók.
Szabály Berthollet: egyensúlyt a ioncserélő reakciót felé tolódik a kialakulását a legkevésbé disszociált vegyületek.
Ennek megfelelően, az irányt ioncserélő reakciók határozzák meg a következő ökölszabály: ionos reakció lezajlásának képződése irányába toljuk el a csapadék, gázok, elektrolitok gyenge, komplex ionok.
Írásakor egyenletek ionos reakciók erős elektrolitok vannak írva a disszociált formában, gyenge - a nem disszociált.
AgNO3 + NaCl ® AgCl¯ + NaNO3
A megoldás: Ag + + NO3 + Na + + Cl- ® AgCl¯ + Na + + NO3.
Kizárása ionokat, amelyek nem lépnek kölcsönhatásba, akkor az egyenlet a következő alakú:
Ag + + Cl- ® AgCl¯.
Egyenletek az ilyen típusú ismert ion.
Ion egyenlet megszerzése a ferri-hidroxid van írva a következő:
Fe3 + + 3OH- ® Fe (OH) 3¯.
Na2S + H2SO4 ® H2S + Na2SO4;
2Na + + S2- + 2H + + SO42 ® H2S + 2Na + + SO42;
Oktatási gyenge elektrolitok:
a. a víz képződéséhez. Reakció, amely akkor fordul elő, hogy vízben történő reakciójával hidrogénionok (valójában, oxónium-ionok) és hidroxid-ionok, az úgynevezett semlegesítési reakció.
NaOH + HCI ® H2O + NaCl
a. a kialakulását egy gyenge bázis.
NH4 + + Cl- + K + + OH- ® NH4OH + K + + Cl-
a. kialakulását egy gyenge sav.
2SH3COO- + 2Na + + 2H + + SO42 ® 2CH3COOH + 3Na + + SO42
CH3COO- + H + ® CH3COOH.
Az ionos terméket víz
A folyamat az elektrolitikus disszociáció víz zajlik két lépésből áll: 1. a kialakulását hidrogénionok és a hidroxid-ionok:
2. hidratálás hidrogénion képez oxónium-ion:
H + + H2O <=> H3O +.
Az első szakaszban a folyamat zajlik a hőfelvétel, a második - a kiadás jelentős mennyiségű. Ezért, szinte az összes hidrogén-ionok hidratált és disszociációs vizet kell bemutatható az alábbi egyenlettel:
2H2O <=> H3O + + OH-.
22 ° C hőmérsékleten a fokát elektrolitos disszociáció víz 1,8 x 10-9, azaz a 555 000 000 vízmolekulák disszociál egy. Következésképpen, a víz - nagyon gyenge elektrolit, és hogy leírja a folyamat a disszociációs alkalmazható a tömeghatás törvénye:
,
ahol K - állandó a disszociációs víz.
Mivel [H2O] = const, kapjuk:
KW állandó úgynevezett ionos terméket víz.
1 liter vizet, amelynek tömege lehet tekinteni, hogy az 1000 g-, 1000 g / 18 g = 55,5 mol hatóanyagra (moláris koncentráció).
Következésképpen, a 22 ° C-on a koncentrációja hidróniumionok és a hidroxid-ionok a következők:
[H3O +] [OH] = 55,5 · 1,8 · 10-9 = 1,000 · 10-7 g ion / liter.
KW mérete növekszik a hőmérséklet növekedésével, mivel ez megnöveli a mértékét elektrolitos disszociáció:
. Szobahőmérsékleten fogadja a kerekített érték az ion termék víz 10-14.
Vizes oldatai különböző vegyületek előállításához savas, lúgos vagy semleges reakció. A reakcióközeg arányától függ a koncentráció hidróniumionok és a hidroxid-ionok oldatban.
Ha a koncentráció ezen ionok egyenlő legyen, azaz [H3O +] = [OH-], a reakcióközeg semleges. Következésképpen, a víz tartozik tipikus amfoter vegyületek kombinálásával a savas és bázikus tulajdonságok, kifejezve ugyanolyan mértékben.
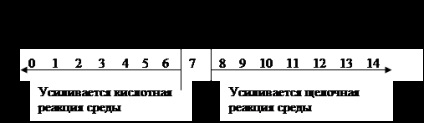
Ha a koncentráció a hidróniumionok nagyobb koncentrációjával hidroxid ionok, azaz [H3O +]> [OH-], a reakcióközeg savas lesz. A savasság magasabb, annál nagyobb a koncentrációja hidróniumionok. Ha ellenkezőleg, az a hidrónium ionok koncentrációja kisebb, mint az a koncentráció a hidroxid-ionok, azaz [H3O +] <[ОН-], то реакция среды становится щелочной. Следовательно, по значению концентрации этих ионов можно количественно охарактеризовать реакцию среды.
A savasság vagy bázicitást fejezhető azáltal, hogy a hidrogénionok koncentrációját helyett annak logaritmusa. Ahhoz, hogy megszabaduljon a negatív erő a értéke a hidrogénionok koncentrációját, azt javasolják, hogy egy negatív értéket a logaritmusa érték [H +], az úgynevezett pH-érték vagy a pH-érték:
hozott Kw = 10-14 (22 ° C) A gyakorlatban, itt [H +] = 10-7 g ion / l, és pH = 7.
Közötti arány a reakcióközeg, koncentrációja ionok és a hidrogén-index értékeket az alábbiak szerint kapjuk:
Semleges közegben [H3O +] = [OH-] = 7,10 g-ionok / l, pH = = 7.
Savas környezetben [H3O +]> [OH -]> 10-7 g-ion / liter, pH = <7.
Lúgos körülmények között [H3O +] <[ОН-] <10-7 г-ион/л, рН> 7.
Ez képviseli a rendszer:
Hidrolízise - a kölcsönhatása ionok sós vízzel, képződését eredményezi Valamely gyenge elektrolit.
Ha a só minősül savas reakcióterméket egy bázissal, attól függően, hogy erőt az összes só lehet osztani négy fajta séma szerint.
IV: CH3COONH4, Al2S3
Sók Az első típusú nem hidrolízisnek vetjük alá, mivel kölcsönhatásba lépnek a vízzel gyenge elektrolitok nem szerezhető. A rendszer H2O ↔ H + + OH- egyensúly megbomlik. A pH-t a megoldások ezen sók egyenlő 7.
Tekintsük a hidrolízise a maradék három típusú sókkal. Képzett sók mnogokislotnymi bázisú savak vagy bázisok, fokozatosan hidrolizáljuk, mozgó első fázisban, hogy savas vagy bázikus sók.
Lépek 2Na + + CO32- + HOH <=> Na + + HCO 3 + Na + + OH-
CO32- + HOH <=> HCO3- + OH-;
Stage II Na + + HCO 3 + HOH <=> H2CO3 + Na + + OH-
HCO 3 + HOH <=> H2CO3 + OH-.
Hidrolízis Na2CO3 és más sók ilyen típusú felhalmozódnak OH- ionok oldatban, tájékoztatva őt lúgos pH> 7 erősen expresszálódik, mint az első szakaszban a hidrolízisre, mint a második.
I. fokozat: Zn2 + + + 2CI- HOH <=> ZnOH + + Cl- + H + + Cl-
Zn2 + + HOH <=> ZnOH + + H +;
Level II: ZnOH + + HOH + Cl- <=> Zn (OH) 2 + H + + Cl-
ZnOH + + HOH <=> Zn (OH) 2 + H +.
Hidrolízis ZnCl2 és más sók ilyen típusú felhalmozódnak oldatban az ionok H +, tájékoztatva őt reagáltatunk egy savas pH- <7.
NH4 + CH3COO- + HOH <=> NH4OH + CH3COOH.
Az ilyen típusú sókat viszonylag könnyen hidrolizálható. A reakció-oldatot és a pH-t úgy határozzuk meg, a relatív erőssége a kapott bázisok és savak. Abban az esetben, elektrolitikus disszociációs állandókat NH4OH és CH3COOH 25 ° C-on rendre 1,79 · 10-5 és 1,76 · 10-5, és ezért a reakció oldat majdnem semleges (pH = 7).
sókat, a hidrolízis folyamata lehet mennyiségileg által leírt két változó: a hidrolízis foka H, hidrolízis állandók Kgidr.
A hidrolízis foka az aránya só molekulák hidrolízisével, hogy a teljes összeg a só molekulák oldatban.
Nyilvánvaló, hogy a hidrolízis foka h változhat az alábbi határokon belül:
0 £ h £ 1 egységnyi részvények
0 £ H £ 100%
hidrolízis állandó helyzetét meghatározó kémiai egyensúly a hidrolízis sóoldatban.
Például, egy egyensúlyi állapot a hidrolízis I. stádiumú és Na2CO3 ZnCl2 Kgidr által kifejezett egyenletek:
.
Általában Kgidr változik az alábbi határokon belül:
£ 0 £ Kgidr
.
A hidrolízis körülményei egyensúlyát nagymértékben befolyásolja a különböző tényezők: elsősorban a víz koncentrációja az oldatban, és a hőmérséklet a rendszer.
Amint látható az egyenlet a teljes hidrolízis
só + víz <=> sav + bázis
és az egyenlet a hidrolízis konstans
koncentrációjának növelése a víz (vagy módosítsa a sókoncentráció) a megoldás, mert a állandóságának Kgidr eltolja az egyensúlyt, balról jobbra. Ezért, híg sóoldatok és teljesen hidrolizált gyorsabb, mint a koncentrált, és a hidrolízis foka növekszik hígító oldattal.
Változások a hőmérséklet is nagyban befolyásolja a feltétele a hidrolitikus egyensúlyi a hőmérséklet növekedésével a hidrolízis foka növekszik, mivel egy éles növekedése az ionos termék víz.
Glinka NL Általános kémia. - M. Chemistry, 1978. - P. 228-260.
A dielektromos állandó e * jellemzi dielektromos polarizáció az elektromos mező által E.