Nuklidok izotópjai
Ha fix száma A, Z, és nem veszi figyelembe a belső szerkezet az atommag, akkor kap egy bizonyos fajta atomok, azaz egy bizonyos nuklid. Ne keverjük össze „izotóp” fogalmak és „nukleonra”: Mindkét szó származik a latin „a mag” - „core”, de nukleonra - egy részecske, amelynek tagjai a mag, és a nuklid - az a fajta atomból egy adott készítmény a magok (Z protonok, N neutronok ).
A kémiai természete az elektron felhő egy atom van megadva, és annak összetétele függ a nukleáris töltés, azaz a száma az összes atomok Z. Ezért, az egyik a kémiai jellege a mag azonos töltés. Ezért, kémiai elem - egy gyűjtemény atomból egy előre meghatározott értéket Z. magtöltés száma Z Ezért nevezték atomszáma, mint a periódusos rendszer elemei vannak elrendezve emelkedő Z.
Ha nuklidok különböző tömegszám A, de azonos atomszámú Z, akkor ugyanolyan kémiai természete, tartoznak egy és ugyanazon elem, és izotópjai, hogy elem. Ahhoz, hogy kijelöl egy speciális izotópja egy kémiai elem szimbólum attribútum bal felső szám, például:
Kémiai elem hidrogén
Amint a táblázat mutatja, a természetes hidrogén formájában létezik három izotópok, a ott is saját kémiai szimbólum deutérium és a trícium.
De nem minden sor protonok és a neutronok adhat stabil atommag. Előfordul, hogy a mag képes spontán szétesik, fordult egy másik kernel. Ezt a jelenséget nevezzük radioaktivitást. és a bomlási folyamat általában követi a sugárzás - sugárzás.
(Mintegy 250)
Egyenletek radioaktív bomlás egyenletek vannak írva, mint a kémiai reakciók. Például, a trícium atom bomlik hélium-3-ionok, az elektron és az adott részecske, amely az úgynevezett elektron antineutrinó:
Ugyanakkor tudatában kell lennie, hogy a radioaktív bomlás nem kémiai folyamat. mert ha van egy közös átalakulása atommagok.
A legtöbb radionuklidok a természetben nem található, és mesterségesen előállított. A stabilitást az általában jellemző az felezési t1 / 2 - egy olyan időintervallumot, amely alatt a valószínűségét összeomlása az atommag 50%. A felezési idő változhat a másodperc tört része billió sok billió év.
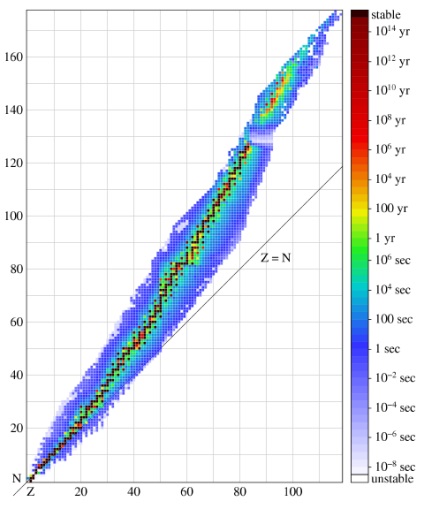
Ez az ábra azt mutatja, egy diagram nuklidokat. ahol a koordináták (Z, N) leképezett ismert nuklidok; négyzetek színe attól függ nuklid- stabilitás mértékének megfelelően jobb a felezési ideje. Minden oszlop ebben az ábrában felel meg egy bizonyos értéket, és Z jelentése egy sor izotópok olyan kémiai elemek.
Érdekes tudni! A keskeny lánc legstabilabb nuklidok megfelel az optimális aránya neutronok és protonok. Egy adott tömegű lehet kifejezni, amelyet a képlet
N / Z = 1 + 0,015 A 2/3
A kis értékei esetén a tömeg száma arány az n / Z kapjuk, az egységhez közeli, így a közös elemeket az elsők között izotópok, amelyben N = Z. De akkor Neutrons nagyobb lesz, és például, stabil izotópok ólom számuk meghaladja a protonok száma körülbelül a fele alkalommal.
Az izotópok kémiai elemek azonos kémiai tulajdonságokkal. így nem lehet megkülönböztetni kémiai úton. A természetben, nagyon ritka folyamatok befolyásoló sejtmagokat, és a különböző izotópjai ugyanazon elem hasonlóan viselkednek a természetben, így a ugyanaz a vegyület, és ezáltal keverednek egymással. Ennek eredményeként, a izotópok aránya gyakorlatilag független a területen, ahonnan az elem, és körülbelül azonos mentén az egész bolygó. Ez az arány az úgynevezett izotópok természetes izotóp-összetételét az elem.
msredn. = 0,76 · 35 · 37 + 0,24 = 35,5 amu
Az atomok különböző izotópok különböző tömegek, hanem a állandóságának izotópösszetétel ólom, hogy az a tény, hogy az átlagolt értéke a tömeg egy atom az elem folyamatosan. Ez átlagoljuk természetes izotópok értéket, kifejezve atomtömeg egység (amu), egy relatív atomtömeg Ar ezt az elemet. A periódusos relatív atomtömege adni az elemek természetes forrásokból kinyert.
Avogadro-szám (6,02 # 0183, 10, 23) amu pontosan megegyezik egy gramm. Azonban, ha a tömeg egy részecske átlagosan Ar atomi egységek, a tömege egy mól ilyen részecskék elérik Ar gramm. Például, m (1 mol Cl atomok) = 35,5 g
Mass adott atom kifejezve amu nagyon közel a tömegét a szám, mivel a tömege nukleonra közelítőleg egyenlő 1 amu de csak az atom A nukleonok. Ezért, ha a természetben uralkodó bármelyike izotópot az elem értékét Ar ez az elem közel lesz a tömegszámú izotóp túlsúlyban. Éppen ezért a relatív atomsúlyának sok eleme közel egészek. Azonban, hogy ne legyen zavaros értékek az A és Ar. Számos jellemzi egy adott nuklid, és jelzi, hogy mennyi a nukleonokat tartalmazó atom, és a szám a Ar jellemzi egy sor természetes izotóp egy kémiai elem, és az átlagolt érték azt mutatja, a tömeg az elem atom amu