Michaelis és Menten egyenlet grafikusan - téglalap alakú hiperbola
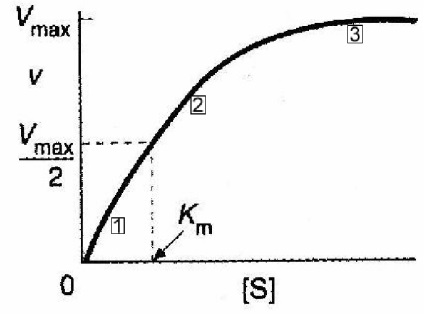
Ábra 2-6. A grafikon a V sebessége a reakció szubsztrát koncentrációja [s] alacsony szubsztrátum koncentrációk (a [s] <0.1 Км, обозначено (1), рис 2-6), можно показать что
.. R e a Michaelis-Menten-egyenletbe az következik, hogy v = k [S]; A reakció sebessége egyenesen arányos a szubsztrát koncentrációjával. Ez - a reakció az elsőrendű. Az ilyen kinetika arra utal, hogy az enzim nem telített szubsztrátum és egyes enzimek szabadon. Ezért, még adunk szubsztrát, képződéséhez vezet a nagyobb mennyiségű enzim-szubsztrát komplex ES, amely rothadó, ez ad több reakciótermék P.
Magas szubsztrátum koncentrációk (ha a [S]> Km 10, által jelzett 3, ábra 2-6)
Ez azt jelenti, hogy a reakció sebessége lett független a szubsztrátum koncentráció. (Nulladrendű reakció), és ez lehet az a tény magyarázza, hogy az összes enzim molekulákat telített a szubsztráttal. Ezenkívül nagyobb mennyiségű szubsztrát oldat nem növeli ES, ezért a sebesség nem változik.
Dependence zóna között az 1. és 3. a grafikonon vegyes.
A fentiekből következik, egy másik fontos következtetés, hogy ha a szubsztrátum koncentrációja 0,1 Km és 10 Km, enzimeket hatékonyan használjuk veszteség nélkül az irányítás a részét a szubsztrát. Ezen a tartományon belül, változások a szubsztrát koncentráció tükröződnek változások a reakció sebességét.
Milyen fizikai znachenieKm? Michaelis-Menten egyenlet átalakítható az ilyen típusú
Ebből az egyenletből könnyen azt mutatják, hogy
Azaz, Km = [S], ha a reakció sebessége fele a maximális sebesség, és így ez a kifejezett koncentráció-egységekben. Feltételezve, hogy k3 < Km értéke is ad néhány ötletet a viszonylag hatékony katalízis és a szabályozás. Ha a [S] >> 10 Km, reakció hatékony ( „munka” az összes enzim molekulákat), de a reakció elveszti azt a képességét, hogy szabályozza a szubsztrát mennyisége. Ha a [S] <<0.1 Km, эффективность реакции низка, но имеется хорошее управление скоростью реакции путем изменения концентрации субстрата. Наиболее удобное сочетание эффективности и контроля соблюдается при условии, если концентрация субстрата одного порядка со значениями Km. Эти выводы имеют важное прикладное значение. Если Вы отлаживаете исследование фермента или в клинической лаборатории или исследовательской лаборатории, следует насыщать фермент субстратом. Знание Км позволит Вам оценивать концентрацию субстрата, необходимую для гарантии насыщения. Эта концентрация должна быть равна по крайней мере двум Км. В физиологических условиях, для эффективной работы концентрация субстрата должна быть на уровне Км этого фермента, но если важно управление концентрацией субстрата, концентрация субстрата должна быть в диапазоне ниже 5 Км. Gyakorlatilag kiszámítja Km érték és Vmax, használva a görbe által leírt egyenlettel Michaelis és Menten komplex. Bebizonyosodott, hogy sokkal kényelmesebb, hogy meghatározza ezeket a paramétereket a koordinátákat a „kettős fordított értékeket.” Michaelis egyenlet képlet ebben az esetben formáját ölti és függőség - egy egyenes vonal (ábra Lineweaver-Burk).
Ábra 2-7. A telek reakciósebesség szubsztrátkoncentráció függvényében. Módszer "dupla reciprok" (Lineweaver-Burk görbe).
Egy ilyen eljárás lehetővé teszi, hogy az expressziós pontosabban értékeit számítjuk Km és V. metszésvonala tengelyével 1 / [S] érték lehetővé teszi, hogy kiszámítja a Km, és a kereszteződés a tengellyel 1 / V - a maximális sebességet.
Michaelis Menten egyenlet, és lehetővé teszi a hatékonyságának kiszámítására az enzim
Kcatili sebesség. Mint a fentiekből kiderül, a maximális sebesség az összes által katalizált reakciók enzimek, érünk el teljes telítettség enzimszubsztrátot, majd a [ES] = [Et], és
Emiatt, K3 (amely más néven kcat teljes telítettségét a szubsztrát) úgy, mint a fordulatok száma, és
A maximális magas értéke kcat / KM, ami által meghatározott frekvencia ütközés a szubsztrát és az enzim függ a diffúziós sebessége a reagensek oldatban. Ez a fajta reakció az úgynevezett diffúzió korlátozott válaszokat. Feltéve, hogy minden ütközés képződéséhez vezet az enzim-szubsztrát komplex diffúziós elmélet szerint a felső határa kcat / KM. mint a megnyilvánulása nagyobb tökéletessége enzimatikus reakció elérheti nagyságrendű értékig augusztus 10-10 a 9 (mol / l) -1 sec -1. A szubsztrátum nem lehet mozgatni, hogy az enzim gyorsabban. Ezek az enzimek, mint karbangidraza, fumaráz és triőzfoszfát valóban megközelíti ezt a határt. Katalitikus sebessége korlátozott, csak a sebesség, amellyel azok ütköznek a szubsztrátum az oldatban. További növekedése sebességet lehet elérni, ha a csökkenés a diffúziós idő. Sőt, sok enzim egy cellában kapcsolódnak a szervezett együttesek, amelyben a termék egy enzim gyorsan követi az enzimet. Tény, hogy a termék áthalad az egyik enzim egy másik, hasonló szállítószalag sorban.
Az alábbiakban egy sor értékek Km, kcat és kcat / Km, amely lehetővé teszi a közölt tartományok ezeket az értékeket.
Értékei Km, kcat és kcat arány / Km táblázatban mutatjuk be a 2-3.
Táblázat 2-3. Km értékeket, az arány a kcat és kcat / Km a különböző enzimek.
Kcat / KM (M / L) -1 sec -1
Etil-N-atsetilGli
Etil-N-atsetilVal
Etil-N-atsetilTir
A letöltés folytatásához össze kell rakni egy képet: