Kénsav - kémiai enciklopédia
Kénsav H2 SO4. mondják. 98,082 m .; bestsv. szagtalan olajos folyadék. Nagyon erős dibázisos-egy 18 ° C-on pK a1 - 2,8, K2 1,2 · 10 -2. pKa2 l, 92; kötések a molekulában S hossza = O 0143 nm, S-OH 0,154 nm HOSOH szög 104 °, OSO 119 °; kelések bomlik. képező azeotrop keverék (98,3% H2-SO4 és 1,7% H2 O fp 338,8 ° C .. Lásd az 1. táblázatot is ..). Kénsav. megfelel a 100% A H2 SO4. Ez egy összetétele (%): H2 SO4 99,5, 0,18, 0,14, H3 O + 0,09, H2 S2 O7 0,04, HS2 O7 0,05. Vízzel összekeverjük, és SO3 minden arányban. A vizes p-PAX kénsavat gyakorlatilag teljesen disszociálnak H +. és. Forms hidratálja H2 SO4 · NH2 O, ahol n = 1, 2, 3, 4 és 6,5.
T ra forró vizet a p-árok kénsavval növekszik a sűrűség és eléri a maximális egy tartalma 98,3% H2-SO4 (táblázat. 2). T RA oleum forrásban növekvő tartalmával SO3 csökken. Amikor a koncentrációja vizes p-árok kénsav felett a teljes gőznyomás p lesüllyed-állítva, és amikor a tartalom 98,3% H2-SO4 elér egy minimális. És növekvő koncentrációban SO3 óleummal összesen gőznyomása fölé emelkedik ez. A víz gőznyomását p-rami kénsav és óleum lehet kiszámítani ur-niju: LGP (Pa) = A - B / T + 2,126, az értékek a együtthatók. A és B koncentrációjától függ kénsav. A gőz víz felett rami p-kénsav keverék áll vízgőz. H2 SO4 és SO3. ahol a készítmény a gőz eltér a folyékony készítmény minden koncentrációban kénsavat. kivéve a megfelelő azeotrop.
A növekvő m-ry fokozott disszociációját H2 SO4 H2 O + SO3 - Q, UR-beállított hőmérséklet-függősége az egyensúlyi állandó lnKp = 14,74965 - 6,71464ln (298 / T) - 8 10161 10 4 T 2 -9643,04 / T-9,4577 · 10 -3 T + 2,19062 x 10 -6 T 2 normál nyomáson, disszociációs mértéke. 10 -5 (373 K), 2,5 (473 K) 27,1 (573 K) 69,1 (673 K). A sűrűsége 100% kénsavat lehet azonosítani ur-niju: d = 1,8517 - - 1,1 · 10 -3 t + 2 · 10 -6 t 2 g / cm 3. A növekvő koncentrációjú p-árok kénsav azok hő kapacitása csökken, elér egy minimumot, hogy 100% -os kénsavat. hőkapacitása oleum növekedésével a tartalom SO3 növekszik.
Koncentrációjának növelésével és csökkenő T-ry l csökken hővezető: l = 0518 + 0,0016t - (0,25 + + T / 1293) · C / 100, ahol C a kénsav koncentrációját. % -ban. Max. viszkozitás van oleum H2 SO4 · SO3. növekvő m-ry h csökken. Elektromos. kénsav ellenállás minimális koncentrációban 30 és 92% H2-SO4 és egy maximális koncentrációja 84 és 99,8% H2-SO4. A oleum min. r koncentrációban 10% SO3. A növekvő m-ry r kénsav növekszik. Dielektromos. permeabilitása 100% -os kénsavat 101 (298,15 K), 122 (281,15 K); krioskopich. konstans 6.12, ebulioskopich. állandója 5,33; együtthatók. diffúziós kénsav gőz a levegőben változások t-ry; D = 1,67 · 10 -5 T 3/2 cm 2 / s.
A ernaya sav-elég erős oxidálószer. Különösen, ha a terhelés.; HI és részlegesen oxidálja a HBr, hogy ingyenes. halogének. szén-CO2. S-SO2. oxidálódik tovább. fémek (Cu, Hg és mások.). Így kénsavat csökken SO2. és Naib. erős redukálószerek-S és H2 S. Konc. H2 SO4 H2 részben helyreáll. ami miatt nem lehet használni annak megszáradását. Futóműveket. H2 SO4 kölcsönhatást. minden fémmel. Ez az elektrokémiai. hidrogén-bal oldali sorban feszültségek. a kibocsátást a H2. Oxidokat. Szigetek kommunikációs dil. H2 SO4 ritkák. Kénsav ad két sorozat sók. közepes sav-szulfátok és hidrogén-szulfátok (lásd. Szulfátok szervetlen), és észtereket (lásd. Szulfátok szerves). Peroxomonosulphuric ismert (a-ta Caro) H2 SO5 és peroksodi-kénsav H2 S2 O8 to-meg (lásd. Kén).
Megközelítés. A nyersanyag a kénsav: S, szulfo-dy fémek. H2 S, a kipufogógázok hőerőművek, Fe-szulfátok, Ca és munkatársai. Bas. kénsavat gyártási lépést. 1) A nyersanyag izzítása szerezni SO2; 2) SO2 oxidáció SO3 (átalakítás); 3) abszorpciós SO3. A Prom-STI használt két módszer kénsav előállítása. módon eltérő SO2 oxidációs pin szilárd katalizátorok (érintkezők) és Nitrogén-nitrogén-oxidok. A kapcsolati kénsavval Sovr. használt növények vanádium katalizátorok. felváltották Pt és a Fe-oxidok. Pure V2 O5 gyengék katalitich. aktivitást. meredeken növekvő jelenlétében. alkálifémsók. ahol Naib. K. befolyásolta só elősegíti a szerepe az alkálifémek képződése miatt az alacsony olvadáspontú pirosulfovanadatov (3K2 O7 S2 · V2 O5. 2K2 O7 S2 · V2 O5 és a K2 S2 O7 · V2 O5. Pusztuló ill. A 315-330, 365-380 és 400-405 ° C). A hatóanyagot a katalízisben körülmények között az olvadt állapotban.
Reakcióvázlat oxidációja SO2 SO3 képviselheti. módon:
Az első szakaszban az egyensúly beáll. második szakaszban lassú folyamat, és határozza meg a sebességet.
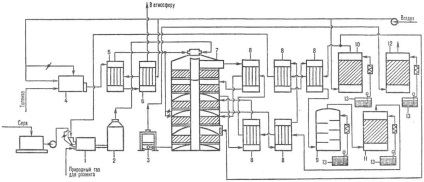
2. ábra. Reakcióvázlat termelési szigetek kénsav, hogy-azt pirit a: 1-lemez adagoló; 2-sütő; 3-hőhasznosító kazán; 4-ciklonok; 5-ESP; 6-súrolás tornyok; 7-nedves elektrosztatikus porleválasztók; 8-stripping torony; 9-szárító toronyban; 10 bryzgoulovitel; 11, az első abszorber-monohidrát; 12 hő-wiki; 13 - érintkeztető berendezés; 14-Oleum abszorber; 15 másodperces abszorber-monohidrát; 16 hűtőszekrények; 17 gyűjtemények.
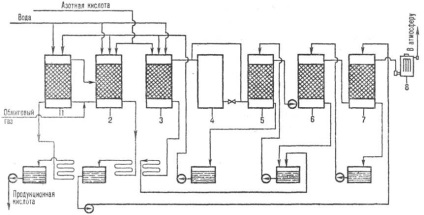
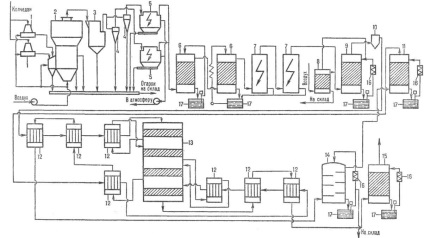
Ábra. 3. rendszer gyártása szigetek kénsav to-te NITROZO NYM módszer: 1 - denitrálással. torony; 2, 3, az első és a második termék. torony; 4-oxid. torony; 5, 6, 7-felszívódását. torony; 8 - ESP.
0,5% jut a második átalakítási lépésben a-menny jelentkezik egy vagy két katalizátor réteget. Előmelegített gáz al. Csoport hőcserélők, hogy 420 ° C a hő hatására gázokat. elérve a második szakaszban a katalízis. Elválasztása után SO3 a második abszorpciós szakaszban, a gázt a légkörbe bocsátják.
A konverziós foka SO2 SO3 az érintkezési módszer 99,7%, a felszívódás mértékét az SO3 99,97%. Prod kénsav hajtjuk végre egy lépésben a katalízis. Az átalakulási fok SO2 SO3 nem haladja meg a 98,5%. Megelőzően, hogy kiadja a légkörbe gázt tisztítjuk a fennmaradó SO2 (cm. Súrolás). Teljesítmény Sovr. létesítmények 1500-3100 t / d.
ÖSSZEFOGLALÁS dinitrogén módszerrel (ábra. 3) az, hogy a kemence gáz a hűtést követően és portalanító kezeljük m. Úgynevezett. nitrozil-kénsav. Egy raj sol. nitrogén-oxidok. Nitrozo SO2 felszívódik, majd oxidálja: SO2 + N2 O3 + H2 O. H2 SO4 + NO. A kapott nem rossz oldhatósága. egy nitrozo és felszabadult belőle, majd részlegesen oxidált oxigénnel gázfázisban NO2. A keveréket a NO és NO2 szívódik vissza a kénsav, stb A nitrogén-oxidok nem fogyasztott a folyamat salétromos, és visszatért a termelés. ciklus miatt hiányos felszívódása kénsav azok részben elragadta a kipufogógázok. Pluses dinitrogén módszer: egyszerű hardver tervezés, alacsonyabb költség (10-15% -kal alacsonyabb, mint az érintkező), a lehetőséget a 100% -os SO 2 feldolgozásra.
Hardver design a torony dinitrogén folyamat egyszerű: SO2 alakítjuk 7-8 tornyok bélelt kerámia. található. az egyik a tornyok (üreges) állítható oxidálja. kötet. Tornyokat gyűjtemények-te, hűtőgépek, szivattyúk. takarmány-in a nyomástartó edények a tornyok. Mielőtt az utolsó két torony beállított farok ventilátor. Tisztítása a gáz kénsav aeroszol elektrosztatikus. Nitrogén-oxidok. szükséges a folyamat nyert HNO3. Ahhoz, hogy csökkentsék a nitrogén-oxidok kibocsátása a légkörbe, és egy 100% -os SO 2 között feldolgozásra egy termék, és abszorpciós zónát van beállítva beznitrozny SO2 feldolgozási ciklus kombinálva egy vizes savas mély csapdázási nitrogén-oxidok. A hátránya, dinitrogén eljárás gyenge minőségű termékek: a kénsav koncentrációja 75%, a nitrogén-oxidok. Fe és mtsai. Szennyező anyagok.
Kénsav kolorimetriásan határoztuk fotometriásan és, mint egy szuszpenzió BaSO4 - fototurbidimetricheski és Ku lonometrich. módszer.
Alkalmazás. Kénsavat alkalmazunk, a termelés-ve aknázómoly. műtrágyák. mint egy elektrolit az ólom-savas akkumulátorok. a december bányász. k-m, és ezek sói. Chem. szálak, festékek. a füst-képző-és a BB, az olaj, fém, textil, bőr, stb industries Prom-STI. Ezt alkalmazzák az ipari. org. szintézisét a p-TIONS kiszáradás (előállítására dietil-éter. észterek) hidratációs (etanol etilén), a szulfonált (Synthetic. Mosás -VA és intermedier. termékek a termelés-ve színezékek) alkili-TION (előállítására izooktán. polietilén-glikol. Capri laktám) és mások. A legnagyobb fogyasztói kénsav be pro-Miner. műtrágyák. A 1 m P2 O5 foszfor műtrágyák elhasznált kénsav 2,2-3,4 m. és m értéke 1 (NH4) 2SO 4 -0,75 tonna kénsavat. Ezért arra törekszenek, hogy építsenek egy kénsav növényi kombinálva növények pro-woo miner. műtrágyák. Világ pro kénsav 1987 eléri a 152 Mill. T.
A ernaya sav és oleum - rendkívül agresszív szigetek, hit dyhat. traktus, a bőr. nyálkahártyák, ami légzési nehézséget okozhat. köhögés, gyakran, gégegyulladás, légcsőhurut, bronchitis és hasonlók. d. MPC kénsav aeroszol a munkatérben a 1,0 mg / m 3 atmoszféra nyomáson. levegő 0,3 mg / m 3 (max. munkát), és 0,1 mg / m 3 (átlagos érték). Befolyásolja a kénsav koncentrációját savas gőzök 0,008 mg / l (60 perces expozíció), a halálos 0,18 mg / l (60 perc). Az aeroszol veszélyességi osztály 2. Kénsav képezhető a légkörben eredményeként kémiai kibocsátás. és kohászati. a pro-oxidot tartalmazó S, és ősszel, mint a savas eső.
Irod Sernokislotchika Handbook, szerk. KM Malina, 2nd ed. M. 1971 Amelin A. G. Technology kénsavat. 2nd ed. M. 1983, Vasilev B. T. Technology Otvagina MI kénsavat. M. 1985. Y. Filatov.
