Job 16
Meghatározása a disszociációs állandók
Célkitűzés: mértékének meghatározására és állandóit a disszociációs egy gyenge szerves sav és különböző koncentrációkban.
Eszközök és reagensek:
1. Oktatási laboratóriumi komplex „Chemistry” a következő elemeket tartalmazza:
- Module „Elektrokémiai” teljes két ezüst elektróddal vezetőképesség mérésére, és egy hőmérséklet-érzékelő;
- üveg 50 cm 3;
2. Az ecetsavas oldatot, amelynek koncentrációja 0,1; 0,01; 0,001; 0,0001 M, desztillált vízzel.
Szerint az Arrhenius elmélet, elektrolitok vizes oldatban disszociál töltött részecskék - ionok, amelyek hordozói villamosenergia. Nem minden disszociált elektrolitok egyaránt: az egyik - az erős elektrolitok teljesen oldódni oldatban; mások - gyenge elektrolitok - csak részben. Az utóbbi esetben, az arány a törött molekulák, az úgynevezett disszociációs mértéke (), attól függ, hogy az elektrolit koncentrációtól és a hőmérséklettől.
Oldatban egy gyenge elektrolit közötti disszociálatlan molekulák és ionok, egyensúly alakul
Egy bináris elektrolit:
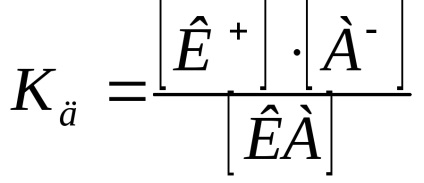
Az egyensúlyi állandó a disszociációs az elektrolitikus folyamat úgynevezett disszociációs konstanssal (Kd).
Tegyük fel, hogy a disszociációfok van . Ha a sav-koncentráció az oldatban egyenlő (mól / l), a koncentráció a kation
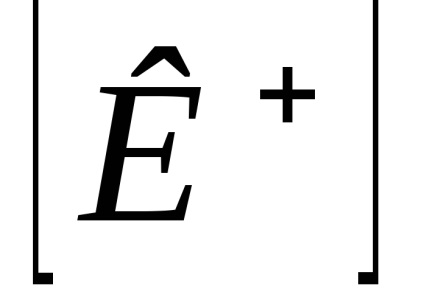
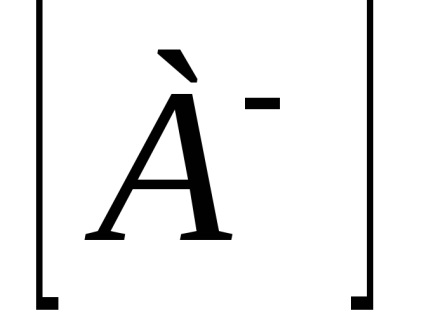
Számított gyakorlati állandó Kd koncentrációjától függ. A koncentrációtól független egy termodinamikai disszociációs, kifejezett aktivitásának ionok és molekulák:
ahol
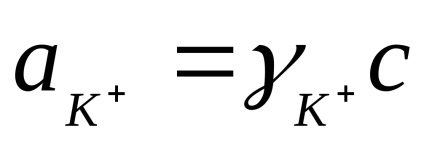
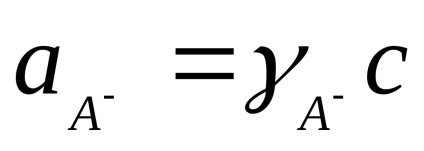
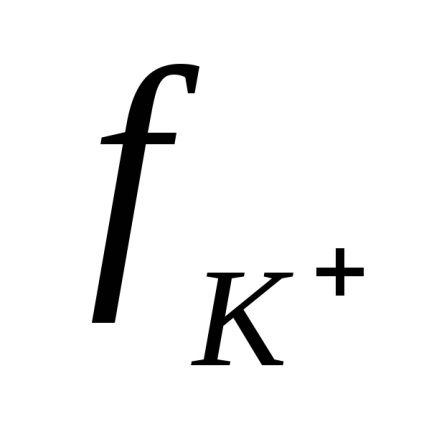
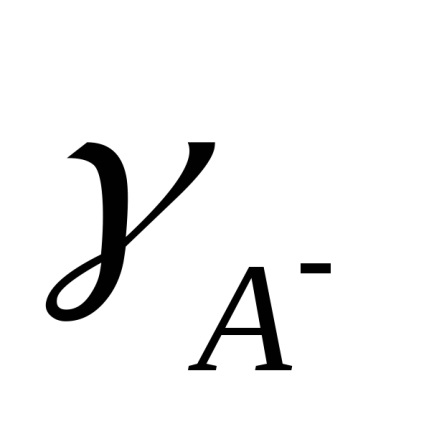
Ionok az elektrolit oldat állandóan véletlenszerű mozgásban. Ha egy külső villamos tér a véletlenszerű mozgását ionokat alkalmazva orientált transzlációs mozgást, hogy az elektróda felületek: kationok - negatív és anionok - a pozitív elektród. Ennek eredményeként az elektromos áram.
A mennyiség, amely jellemzi az képességét egy anyag, hogy végezzen elektromos áram egy külső elektromos mező, az úgynevezett villamos vezetőképesség.
Az elektromos vezetőképesség (G) - a kölcsönös elektromos ellenállás a vezető (R). Mért Siemens (cm): Lásd = ohm -1.
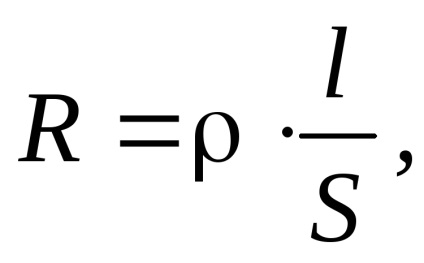
ahol - fajlagos ellenállás; - fajlagos elektromos vezetőképesség; S - keresztmetszeti területe a vezeték; l - hossza a karmester.
Elektromos vezetőképesség az elektrolit oldatban függ az ionok száma a teljes oidattérfogatban az elektródok között és azok sebessége.
Ahhoz, hogy értékelje az oldat vezetőképessége és a befolyása a különböző tényezőket két mennyiség alkalmazunk: specifikus (), és a moláris () elektromos vezetőképesség.
Fajlagos elektromos vezetőképesség () nevezik az oldat vezetőképességét között elhelyezett párhuzamos elektróda területe 1 cm 2 egymástól 1 cm-es. A fajlagos elektromos vezetőképesség mértékegysége az ohm -1 sm Smsm -1 vagy -1.
Molar elektromos vezetőképesség - az intézkedés az elektromos vezetőképesség az összes ionok által alkotott disszociációja egy mól egy adott elektrolit koncentrációjának.
Moláris elektromos vezetőképesség egy elektromos vezetőképessége a mennyiség (V, cm3) az oldat, amely 1 mól oldott anyag, ahol az elektródok vannak egymástól 1 cm távolságra.
A fajlagos elektromos vezetőképesség és a mólarány a kötött
ahol a C - koncentráció moll;
- moláris elektromos vezetőképesség (ohm -1 sm mol 2 -1) 2 vagy Smsm mol -1;
- fajlagos elektromos vezetőképesség (ohm -1 sm -1) -1, vagy Smsm.
Mivel az elektromos vezetőképessége az elektrolit oldat térfogata határozza meg az ionok száma abban, hordozó villamos, valamint azok a migráció sebessége a moláris vezetőképességét kapcsolatban
ahol U +. U- - abszolút mozgás sebessége az ionok (azaz a mozgás sebessége a területen erőt 1 · cm-1 ..); - disszociációs mértéke az elektrolit; F - Faraday számát, azaz a villamosenergia-mennyiséget, amely hordozza egy mol egyszeres töltésű kationok vagy anionok ...
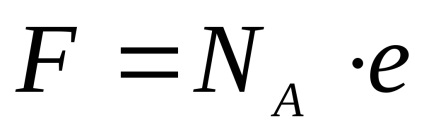
e - 1,610 -19 Kl - elektron töltése.
Amikor hígított oldatot moláris elektromos vezetőképessége mind erős és gyenge elektrolitok növekszik: a gyenge elektrolitok - növekedése miatt a disszociációs mértéke (), az erős - növelésével abszolút sebessége ion mozgás
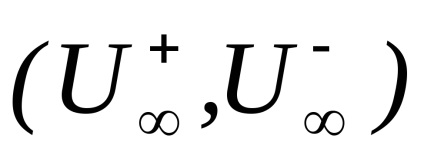
Határérték . megfelelő moláris elektromos vezetőképesség hipotetikus végtelenül hígított oldat, azzal jellemezve, hogy egy teljes disszociációja az elektrolit és a hiánya erők közötti elektrosztatikus kölcsönhatás az ionok összhangban (4) fejezhető ki a kapcsolat
a művek
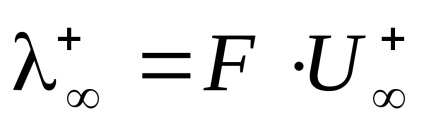
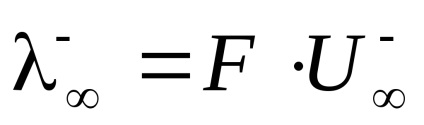
Moláris elektrolit elektromos vezetőképesség végtelen hígítás () összegével egyenlő limit mobilitásának anionok és kationok.
(6) egyenlet van beállítva Kohlrausch és hívják a törvény független ion mozgás.
A korlátozó ionos mobilitási függ csak a az oldószer jellegétől és a hőmérséklet; Sok ionok ez az érték kísérletesen meghatározott adják a hivatkozásokat.
Moláris elektromos vezetőképesség oldatok gyenge elektrolitok kisebb, mint erős. Ez annak a ténynek köszönhető, hogy a még kis koncentrációban is, a disszociációs mértéke gyenge elektrolitok kicsi ( 1), így, annak ellenére, hogy az oldat térfogatát mellékelt az elektródok között, az elektrolit tartalmaz 1 mol, transzporterek ionáram ebben a mennyiség kevesebb mint az erős elektrolit oldat. Növelése moláris elektromos vezetőképesség gyenge elektrolitok hígításkor megoldásokat társult növekedésével disszociációs mértéke.
Egyenletekből (4) és (5):
ahol
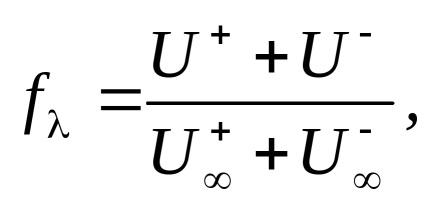
A abszolút sebessége ion mozgás híg elektrolit oldatok (U +. U-), és egy végtelenül hígítjuk (U + . U-) közel vannak egymáshoz (
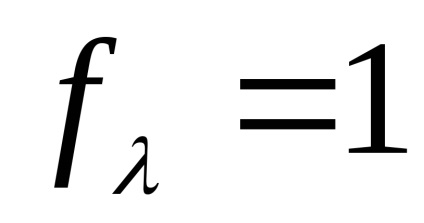
Így a disszociációs mértéke az elektrolit oldat egy adott koncentrációban lehet kiszámítani mérésével moláris elektromos vezetőképességét oldat és tudni . amely lehet kiszámítani a (5) képletű.