Ion-molekuláris egyenlet - Kémiai
2.6 Ion-molekuláris egyenlet
Amikor bármilyen erős neutralizáló bármely olyan sav erős bázis minden mól képződött vizet számára mintegy 57,6 kJ hő:
HCl + NaOH = nátrium-klorid + H2 O + 57,53 kJ
H + + Cl - + Na + + OH - = Na + + Cl - + H2 O
Figyelembe véve a kapott egyenlet, azt látjuk, hogy a reakció során az ionok Na + és Cl - nem változott. Ezért átírni újra, így ezek az ionok mindkét oldalán az egyenlet. kapjuk:
Ezért minden semlegesítési reakciót egy erős sav erős bázissal bármilyen mennyiségben, hogy ugyanazt a folyamatot - a vízmolekulák a kialakulását hidrogénionok és a hidroxid-ionok. Egyértelmű, hogy a hőhatás ilyen reakciókban is meg kell egyeznie.
Szigorúan véve, a víz képződése reakciója ionok megfordítható, hogy lehet alábbi egyenlet fejezi ki
H + + OH - ↔ H2 O
Azonban, amint látni fogjuk, a víz - nagyon gyenge elektrolit-höz, és csak elhanyagolható mértékben. Más szóval, az egyensúlyt a víz molekulák és ionok erősen eltolt keletkezése irányába molekulák. Ezért szinte semlegesítési reakciót egy erős sav erős bázissal továbblép a végén.
Ha összekeverjük a megoldást ezüstsó sósavval, vagy egy oldat bármely sóját mindig keletkezik egy jellegzetes, fehér túrós csapadék ezüst-klorid:
Hasonló reakciókat is csökkenthető egy folyamat. Annak érdekében, hogy a molekula-ion egyenlete újraírása, például az egyenlet az első reakció, felvétel erős elektrolitok, mint az előző példában, ionos formában, és az anyag található, a csapadékot a molekuláris:
Amint látható, ionok H + és NO3 - nem változik a reakció során. Ezért kizárják őket, és átírni újra:
Ag + + C1 - = AgCl ↓
Ez ionos folyamat egyenletét.
Ott is figyelembe kell venni, hogy az ezüst-klorid csapadék egyensúlyban van az ionok Ag +, és a C1 - oldatot, úgy, hogy a folyamat által kifejezett az utolsó egyenlet, invertálható:
Ag + + C1 - ↔ AgCl ↓
Azonban, mivel az alacsony oldhatósága ezüst-klorid, ez az egyensúly erősen jobbra tolódik. Feltehető tehát, hogy az AgCl képződési reakcióját az ionok gyakorlatilag véget ér.
AgCl csapadék képződés lép fel, ha az egyik megoldás lesz jelentős koncentrációban Ag + ionok és a C1 - .Poetomu ezüst-ionok jelenlétében kimutatható C1 ionok oldatban - és fordítva, a klorid-ion - jelenlétében ezüstionok; ion C1 - szolgálhat a reagensként a ion Ag +. és ion-Ag + - ion reagenst C1.
A jövőben mi lesz, hogy széles körben használják a ion-molekula formában az egyenleteket reakciók elektrolitok.
Made by ion-molekula egyenletek tudnia kell, mely sók vízben oldódnak, és amely gyakorlatilag oldhatatlan. Általános jellemzői a vízben való oldhatósága a legfontosabb sót a 2. táblázatban megadott.
Ion-molekula egyenlet, hogy segítsen megérteni a jellemzői a reakciók között elektrolitok. Tekintsük példaként több reakció előforduló gyenge savakkal és bázisokkal.
2. táblázat oldhatósága nagyobb sókat vízben
Anionok és a kationok
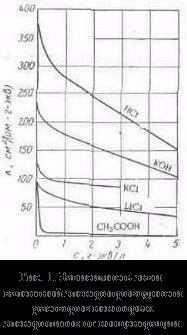
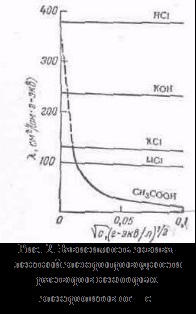
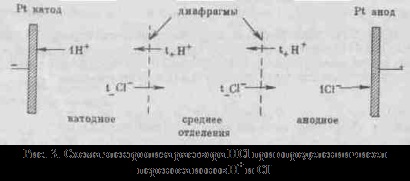
más oldószerekkel, tartjuk a rennye minták tárolása, de vannak eltérések őket, például a kanyarokban # 955; c gyakran megfigyelhető legalább (abnormális elektromos vezetőképesség). 2. Az mobilitása ionok társítani elektrolit vezetőképessége egy mozgás sebessége-CIÓ annak ionok elektromos mező. Kiszámításához Elektroprom vezetőképességű elég megszámolni az ionok száma.

oxigénnel hasznosítás - oxigénhiány. A bevezetés után elektronikus megjelenítőjét kémia fogalmát redox reakciókat is kiterjesztették olyan reakcióban, amelyben az oxigén nem vesz részt. A szervetlen kémia redox reakció (IAD) hivatalosan tekinthető az elmozdulás az elektronok egy atom a reaktáns (redukálószer) egy másik atom (.
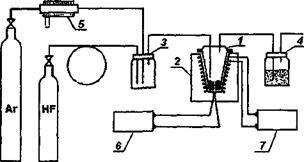
A tanulmány a szintézis az új anyagok és ion transzport folyamatok bennük. A tiszta formában, ilyen mintákat lehet felismerni világosabban a tanulmány az egykristály szilárd elektrolit. Ugyanakkor, a szilárd elektrolitok a dolgozó média funkcionális elemek kell venni, hogy az anyagokat kell egy bizonyos típusú és alakú, mint például a sűrű kerámia.
17-25 kg / t timsó-TION, hogy
10-15 kg / m-nél nagyobb az eredményeket a kutya-chanogo alumíniumoxid. Az alumínium-oxid előállítására alkalmazott alumínium, hogy tartalmazza a minimális mennyiségű vas vegyületek, szilícium-dioxid, a nehézfémek egy ürítő alsó potenciál a katód, mint az alumínium, mivel ezek a vegyületek könnyen csökken, és átmenetek-DYT alumínium katód. Nemkívánatos, mint a jelen.