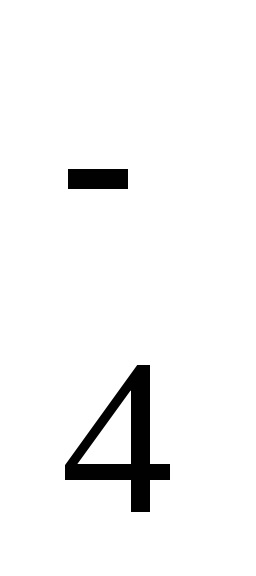Hogyan lehet megoldani a vizsgálatokat a kémia
Az általános képlet egy szervetlen sav - Hy An, ahol An - sav maradék (.. Minden anionjai képlet A 2. táblázatban felsorolt, kromeOH - azok az anionok); y - index (szám).
Az általános képletű okok és amfoter molekulák - M (OH) x. ahol M - fém vagy NH4 (. összes kationok a képlet a 2. táblázatban megadott olyan fémkation); x - az index (szám).
Az általános képlet az átlagos só - Ma Anb. ahol M - fém vagy NH4; Egy - aminosav maradék; a, b - kódok (számok).
1. erős elektrolit képletű - ez.
A) NH4 OH általános képletű bázist (M = NH4), amely, az 1. reakcióvázlatnak megfelelően, egy gyenge elektrolit. Ez rossz válasz.
B) HF sav képletű (An = F), amely, az 1. reakcióvázlatnak megfelelően, egy gyenge elektrolit. Ez rossz válasz.
A) K2 SO4 - általános képletű sók (M = K, An = SO4), amely, az 1. reakcióvázlat szerint, egy erős elektrolit. Ez a helyes válasz.
2. molekuláris reakcióegyenlet. Ez megfelel egy rövid ionos egyenlet.
A átmenet a molekulaion az egyenlet a rövid legyen:
- oldhatóság meghatározására (H, M, P) a résztvevők a reakcióban a táblázat. 2;
- meghatározzuk elektrolitikus tulajdonságokkal rendelkezik (erős elektrolit ilislaby) valamennyi résztvevő oldható reakciót az 1. reakcióvázlat;
- át változatlan, hogy a teljes ionos egyenlet Formula alacsony oldhatatlan anyagokat és gyenge elektrolitok, valamint oxidok;
- levelet oldódik erős elektrolitok formájában képletek azon ionokat, amelyek ezen anyagok lebomlanak, tekintettel arra, hogy az erős savak lebomlanak NaH ian + y -. például H2 SO4 → 2H + + SO



- hagyni a bal és jobb részei a teljes ioncserélő egyenlet azonos képletek ionok (együtt együtthatók), és (ha szükséges), hogy csökkentsék a maradék együtthatókat.
A oldhatósága a elektrolitok vízben szobahőmérsékleten (összes soedineniyaCs +, H +, K +, NH