formális kinetikai
Speed mindig nagyobb, mint nulla, ezért meghatározó a sebesség egy kiindulási put „-” jel .., T koncentrációjának a kiindulási anyagok idővel csökken.
Az arány függ a koncentrációja a kiindulási anyagok, hőmérséklet, nyomás (abban az esetben, gázfázisú reakció).
Az alapvető tétele kémiai kinetika - reakció sebessége minden egyes időpontban arányos a termék koncentrációjának a kiindulási anyagok, épített valamilyen
fok: r = k [A] a [B] b.
A koefficiens arányosság k az úgynevezett állandó a reakció sebességét. A sebességi állandó számszerűen egyenlő a kémiai reakció sebessége egyetlen koncentrációban a reagensek.
A sebességi állandó méret befolyásolja a sorrendben a reakció. Így elsőrendű k = [1 / sec], egy másodrendű k = [l / mól * s]. A konstans nem függ a reaktánsok koncentrációja, ez állandó egy adott hőmérsékleten.
A hőmérséklet hatása a sebességi állandó határozzuk közelítőleg VantGoffa szabály: ha a hőmérséklet emelkedik minden 10 fok reakció sebessége megnő
= Γ 10. ahol k 2 - állandó az új hőmérsékletet, k 1 - állandója
kezdeti hőmérséklet, γ - van't Hoff faktor.
kinetikai görbék
Kinetic görbét úgy a koncentráció az i-edik komponense
reakcióidő.
Keressük a függőség a koncentráció az idő függvényében reakciók 0-3 nagyságrenddel. Nulladrendű reakció sebessége nem változik az idő múlásával:
A lejtőn érintőjének bármely pontjára a görbe egyenlő lesz a reakció sebessége egy adott időben az ezt a komponenst.
Az egyértelműség kedvéért, a kinetikai görbék gyártani koordinátákat, amelyben a kinetikus görbe válik egy egyenes vonal, t. E. A linearizált. Ehhez a reakcióhoz mintegy 1 koordináták LNC = f (t), kb 2 - 1 / C = f (t).
Az, hogy a reakció r = k [A] a [B] b
Magántulajdonban, a reakció az úgynevezett sorrendjét reakció az i-edik komponense. egy - a reakció érdekében, hogy a komponens a, b - a reakció érdekében, b, komponens. Az általános sorrendje a reakció - az az összeg, magántulajdonban: n = a + b.
Molekuláris reakciók részecskék számát részt az egyik elemi aktus kémiai átalakulás.
Különbséget mono-, bi- és trimolekuláris reakciót. Vesz részt a reakcióban több mint három részecskéket kell tekinteni, mint egy komplex reakciótermék át bekövetkező több elemi lépést, amelyek mindegyike mono-, biili trimolekuláris. Az egyszerű egylépéses homogén reakciók molekularitás egyenlő a sorrendben a reakció.
A fél-időt nevezik egy időintervallumot, amely a kezdeti koncentráció a reagensek a felére csökken.
Időt, hogy fél reakciói 0-3 nagyságrenddel.
nulladrendű reakció: CA = - kt + C 0 C 2 0 = - kt 1/2 + C 0 t 1/2 = C 2k 0 elsőrendű reakció: CA = C 0 e - kt C 2 0 = C 0 E - kt 1/2 ln február 1 = - kt 1/2 t 1/2 = ln2 k
Integrált módszerek megtalálására sorrendben reakcióban.
1) helyettesítő módszer - helyettesítő kapott értékek idő és a kiindulási anyag koncentrációja a kinetikus egyenletek különböző rendű, azt találjuk, az állandó a reakció. Az, hogy a reakció, amelyben az egyenlet konstans állandó minden értékére.
2) grafikus módszerrel - konstrukció grafikus koordináták C - t, LNC - t, 1 / C - t, 1 / C 2 - t. Az alábbiak közül melyik grafikon lesz egy egyenes vonal ebben a sorrendben reakciót.
3) Eljárás meghatározására felezési időt - végezzük több kísérletet, különböző kezdeti koncentrációk és határozza meg a fél-időszakokban. Felére-időszak függően a kezdeti koncentráció határozzák meg sorrendben a reakció. Ily módon tudjuk számítani az, hogy a reakciót a
képlet: n = lg t '1' / 2 - lg t '1/2 + 1 ismerve a felezési időt, két különböző lg c' '0 - lg c' 0
a kezdeti koncentráció. Az, hogy a reakció lehet frakcionált.
4) Emanuel-Knorre módszer lehetővé teszi, hogy kiszámítja a sorrendet, reakció képletű:
- átalakulási fok az anyag abban a pillanatban,
idő t 't' - önkényesen kiválasztott időpontban, t '' - egy olyan időpontban, amikor a C '' = (c „) 2.
Differenciál meghatározási módszerét a sorrendben a reakció.
A reakció aA + bB → termékek.
A reakció sebessége R = -
ahol n A. N B - magántulajdonban reakciók.
Szigetelés módja Ostwald. Elvégezzük a kívánt reakció, először egy feleslegben lévő kiindulási anyagok egy kivételével. Akkor figyelmen kívül hagyják a változás a koncentrációban az összes reagensből, sőt, amelyen a kiszámítását végzik. Ezután a koncentráció az összes komponensek hozzá állandó együttható, valamint a reakció sebessége a következőképpen írható fel:
= K 1 c 1 n 1. ahol
k 1 n = AKC 20 2
1 N - sorrendben a reakció az első anyag.
Logaritmusa ez a kifejezés:
ln - R A = ln k 1 + n 1 ln c 1.
Szerkesszünk egy grafikont koordinátáit ln (-r A) - LNC 1. minden pontra illeszkedik egy egyenes vonal.
A meredeksége ebben a sorban egyenlő a sorrendben reakciója anyag A. Ez a módszer koncentrációja határozza meg eljárást.
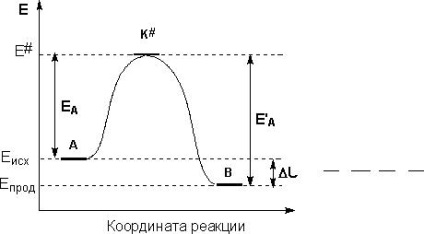
A hőmérséklet hatása a kémiai reakció sebessége
A hőmérséklet hatása a sebességi állandó határozza megközelítőleg VantGoffa szabály: ha a hőmérséklet emelkedik, minden 10 fok fokozatú
a pre-exponenciális faktor - állandó számszerűen egyenlő a kémiai reakció sebessége végtelen hőmérsékleten.
Függvényében ábrázoljuk a koordinátákat lnk - 1 / T, megkapjuk egy egyenes vonal, amely metszi a függőleges tengelyen a szegmens hossza LNA, és ahol a tangense a hajlásszög egyenlő Ea / R.
Kiszámításához az aktiválási energia szükséges, hogy ismerjük a sebességi állandók különböző hőmérsékleteken kialakítása érdekében a grafikon.
Arrhenius egyenlet lehetővé teszi, hogy kiszámítja a sebességi állandó egy bizonyos hőmérsékleten, ismerve a sebességi állandó a különböző hőmérsékleteken:
ln k k február 1 = E R egy (T Január 1. - T 1 2)
Annak meghatározására, az aktiválási energiát az első közelítés, a két sebességi állandók ahhoz, hogy tudja, ha két különböző T.
A hőmérsékleti együtthatója van't Hoff társítható aktiválási energia:
E a = 0,1 R T T 1 2 ln γ
A letöltés folytatásához össze kell rakni egy képet: