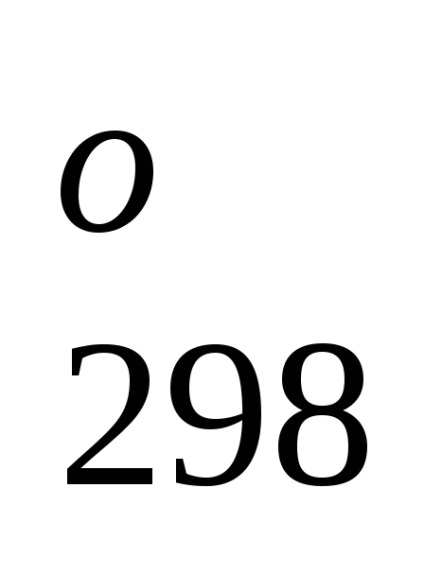Energia és kémiai folyamatok 1
ETO 54: Dr. tehn. Sciences, prof. Lovshenko FG,
cand. tehn. Sciences, Assoc. Lovshenko GF
Az irányelvek alapvető termodinamika. A példák a megoldások tipikus problémák. A feltételek a feladatok önálló munkát.
Véleményező art. Ven. Patsey VF
Felelős kiadás Lovshenko GF
ENERGY kémiai eljárásokkal szemben. kémiai affinitás
Aláírták a nyomtatott formátum 60x84 1/16. Ofszet papír. sablonos sokszorosítás
Vez. Pec. l. Jaj. ki. L. Circulation 215ekz. Rendelési szám _______
Kiadó és nyomtatása:
Az állam felsőoktatási intézmény
Energia Kémiai folyamatok
Kémiai termodinamika tanulmányozása kémiai energiát átmenetek más formában - a termikus, elektromos stb száj-navlivaet mennyiségi törvények ezen átmenetek, valamint a irányát és mértékét a spontán áramlás-nek a kémiai reakciók meghatározott körülmények között ...
A vizsgálat tárgya a termodinamika a rendszerben.
Sistemoynazyvaetsya aggregált vannak inter-akció anyagok, szellemileg (ilifakticheski) álló otokruzhayuschey közegben.
Etochast fázis-rendszerek, homogén minden ponton összetételének és jellemzőinek elválasztjuk a többi rendszer részeinek szakasz felülete.
Különbséget tenni homogén és heterogén ICU témát. Homogén rendszerek állnak egy egyfázisú, heterogén - a két vagy több fázis.
Ugyanez a rendszer lehet a különböző, álló Niyah. Mindegyik rendszer állapotát jellemzi egy bizonyos termodinamikai paraméterek. Ahhoz, hogy egy termodinamika-iai paraméterek közé tartoznak a hőmérséklet, nyomás, sűrűség-ség, koncentráció és m. P. módosítása legalább egy olyan termodinamikai paramétert csak akkor okoz állapotváltozást a rendszer egészének. A termodinamikai rendszer állapotát nevezett vayutravnovesnym ha ez jellemzi egy állandó ter termodinamikai paraméterek minden pontban a rendszer, és nem változik meg automatikusan (ráfordítás nélkül a munka). A kémiai termodinamika rendszer tulajdonságait tárgyaljuk az egyensúlyi állapotban.
Attól függően, hogy a rendszer feltételeit átmenet az egyik állapotból a másikba az termodinamika megkülönböztetni izoterm, izobár, és izochor adiabatikus folyamatok. Trans-TIONS - folytassa állandó hőmérsékleten (T = const), Auto-rozs - állandó nyomáson (p = const), és mások - állandó térfogat (V = const), a negyedik - hiányában a hőcsere a rendszer és a környezetben (q = 0).
Kémiai reakciók gyakran fordulnak elő a izobár-izoterm körülmények között (p = const, T = const). Az ilyen feltételek teljesülnek, ahol közötti kölcsönhatás anyagok történhet nyitott tartályokban melegítés nélkül, vagy egy magasabb, de állandó hőmérsékletű.
A belső energia a rendszer.
Az átmenet az egyik állapotból a másikba a változás bizonyos tulajdonságait, különösen a belső-ness energiyaU.
Vnutrennyayaenergiyasistemypredstavlyaet CO-mérkőzés teljes energiatartalma, amely kineticheskoyi potenciális energia a molekulák, atomok, atommagok, elektronikusan-tron et al. Belső energia tartalmaz energia transzlációs-TION, rotációs és rezgő mozgások és potenciálok, a potenciális energia, által okozott vonzó- és bólogatva-felolvasztással között ható molekulák, atomok, és az intra-atomi részecskék. Ez nem tartalmazza a rendszer állapotáról a térben potenciális energia kinetikus energia és a mozgás-zheniya rendszer egészére.
Az abszolút belső rendszer energiája nem lehet meghatározni, eloszthatók, de lehet mérni U változik az átállás során az egyik állapotból a másikba. Az értéket tekintjük pozitív U-CIÓ (U> 0), ha bármely folyamat belső energia növelése esetén.
A belső energia termodinamicheskoyfunk-tsieysostoyaniyasistemy. Ez azt jelenti, hogy amikor a rendszer ebben az állapotban, csak egy bizonyos energia belső rejlő ebben az állapotban zna-chenie. Ezért, a változás a belső energia nem függ a beadás és módja átmenet az egyik állapotból a másikba, és a rendszer által meghatározott különbség belső energiája két állapot:
ahol U1 és U2- belső energiája a rendszer a végén és az elején Mr. állapotok, ill.
Olyan eljárásban tiszteletben a törvény az energiamegmaradás. alábbi egyenlet fejezi ki
ami azt jelenti, hogy a hő q, szolgáltatott a rendszer, FLOW-lott, hogy növelje belső energia és U pontozási rendszer működik A fölött a környezetre. (2) egyenlet - egy matematikai kifejezést az első főtétele.
A termodinamika első főtétele azt jelenti, hogy a növekmény a belső energia U rendszer bármely folyamatban mindig coli hőre operációs rendszer üzenetet q mínusz száma Tökéletes rendszer működését; Mivel az értékek a Q és A-jelentése közvetlen méréssel, a (2) egyenlettel mindig lehetséges értékének kiszámításához U.
A termodinamika első főtétele munkahelyi podrazume És az összeg minden típusú munka ellen ható erők részéről a környezet rendszer. Ez az összeg bemenjenek és munka erői ellen a külső elektromos tér, és a munka erői ellen a gravitációs mező, és a munka expanzió erőivel szemben a külső nyomás, és egyéb tevékenységek.
Annak a ténynek köszönhetően, hogy a legtöbb kémiai reakciók jellemzője az expanziós munka, ez általában izoláljuk a teljes összegét:
ahol A „- mindenféle munkát, amellett, hogy a munkát a növekedés;
p - rá külső nyomás;
Ha közben az áramlás egy folyamat működés kiterjesztése rénium az egyetlen művelet típusát, (3) egyenlet válik
Ezután a matematikai kifejezést az első főtétele-O My (2) felírható:
ahol qp - külső hőt a rendszer állandó adás-lenii.
Behelyettesítve entalpiája H (6) egyenlet, megkapjuk
t. e. a külső hőt a rendszer állandó nyomáson, költik a változás entalpia rendszer.
Csakúgy, mint a belső energia, az abszolút értéke entalpiája a rendszert nem lehet kísérleti úton meghatározni, de lehetőség van arra, hogy mérjük az érték qp, megtalálja N entalpiaváltozást való átmenet során az egyik állapotból a másikba. N értéket tekintjük pozitív (N> 0), ha a entalpiája a rendszer vozras-olvadékok. Mivel N érték különbség határozza meg (H2-H1), és független az útvonal és módja eljárás foganatosítására, entalpia, és a belső energia, mint a, lásd a termodinamikai funkció-tsiyam rendszer állapotáról.
Termikus hatások kémiai reakciók.
A algebrai összege-edik során elnyelt hő a reakció és a munka kevésbé tökéletes működése ellen a külső nyomóerő hatásának (rV) vayutteplovym nevezett hatás a kémiai reakció.
Termokémiai törvényeket. Függetlensége a kémiai reakció hőt a folyamat útját, amikor p = const és a T = const van szája-munka első felében a XIX. A magyar tudósok G.I.Gessom: standard képződési entalpia nem függ a módját annak pro-szivárogna, és csak attól függ, hogy milyen jellegű és fizikai sostoyaniyaiskhodnyh anyagok és reakciótermékek (Hess).
KATEGÓRIA kémiai termodinamika teplovyeeffekty tanul kémiai reakciók nazyvaetsyatermohimiey. A ter-mohimii az egyszerűsített ábrázolása egy termikus kémiai reakció hatása megfelel a feltételeknek annak inde-folyamatban a folyamat útját. Ez a hő qt, szolgáltatott a rendszer a reakció során (vagy alakult ki a reakció) állandó hőmérsékleten.
Ha hőt a rendszer (qt> 0), on-összekötő reakció endoterm, ha a hőt a környezetbe engedni (qT <0), реакцию называют экзотер-мической.
Termokémia elsősorban azt vizsgálja, izobár-izoterm reakció, mint amelynek eredményeként csak a munkát, bővítmények versenyek V. A termikus hatása az ilyen reakciók qp, T egyenlő az entalpia változást H rendszer.
Az egyenletek a kémiai reakciók, amelyek jelzik, hogy hőhatás nazyvayutsyatermohimicheskimi egyenletek. Mivel a fizikai halmazállapot állapotától függ a rendszer egészének, a termokémiai egyenletek segítségével írni index (a), (g), (b) vagy (g) azonosítunk, amely betétek anyagok (kristályos, folyékony, oldott, és a gáz-halmazállapotú másként). Is kimondja allotropic lényegi módosítása, ha több ilyen módosításokat. Ha Gatnoe sta-state anyag vagy annak módosítása meghatározott feltételek mellett nyilvánvaló, levél indexek lehet hagyni. Például, atmoszferikus nyomáson és szobahőmérsékleten, gáz halmazállapotú hidrogén és oxigén (természetesen), és képező Xia kölcsönhatásuk H2 O reakciótermék lehet egy folyékony és gáz-halmazállapotú (gőz). Ezért termohimi-idézésben reakcióegyenlet kell a meghatározott fizikai állapotát H2 O:
Jelenleg venni, hogy jelezze a reakcióhő formájában entalpia megváltozik H. hő egyenlő izobár-izoterm folyamat qp, T. Gyakran előfordul, hogy a entalpiaváltozást kerül rögzítésre H
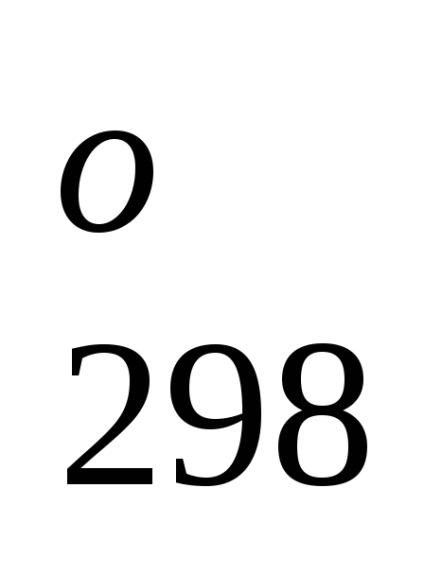
2C6 H6 (g) + 15O2 = 12SO2 6N2 + G (w). H
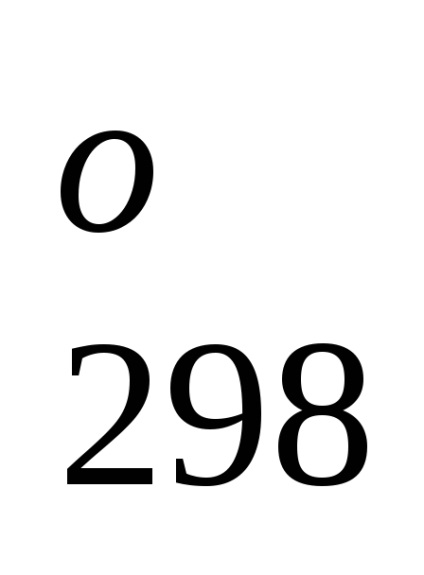
2C (grafit) + C2 H2 = H2. H
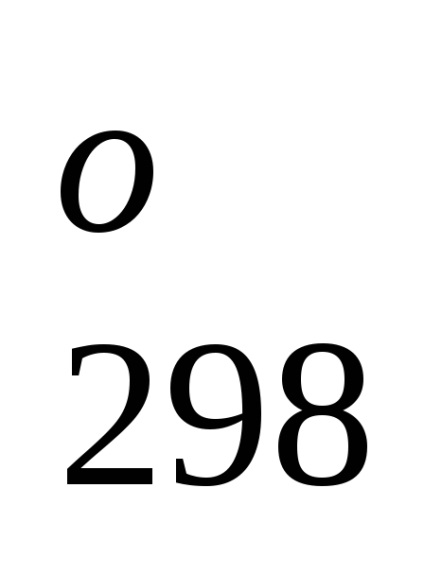
N2 + 3H2 = 2NH3 (g). H
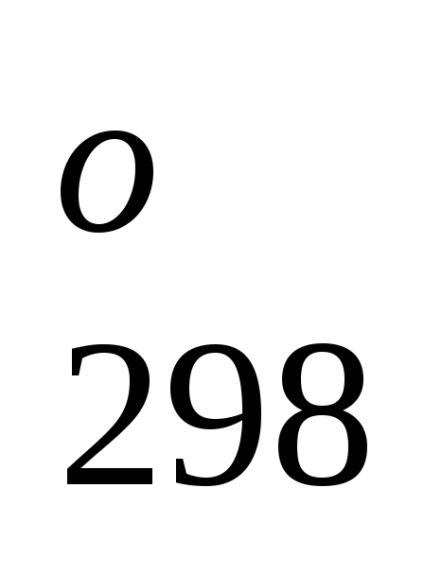
A reakciók (a) és (c) az entalpia csökken a rendszer (H
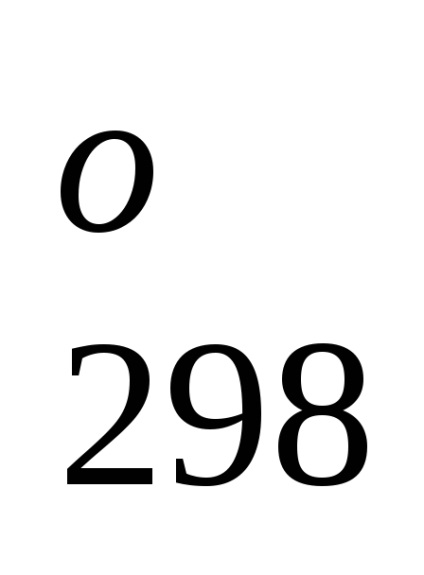
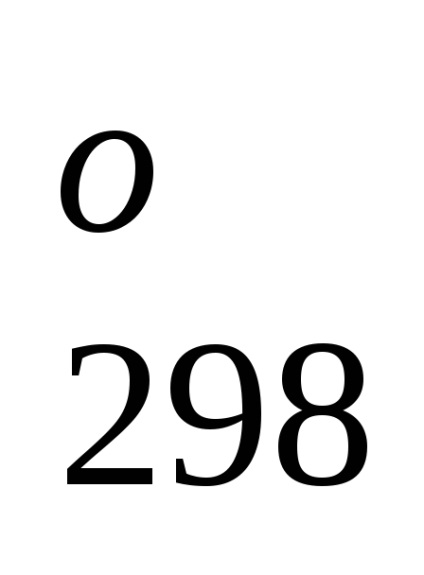
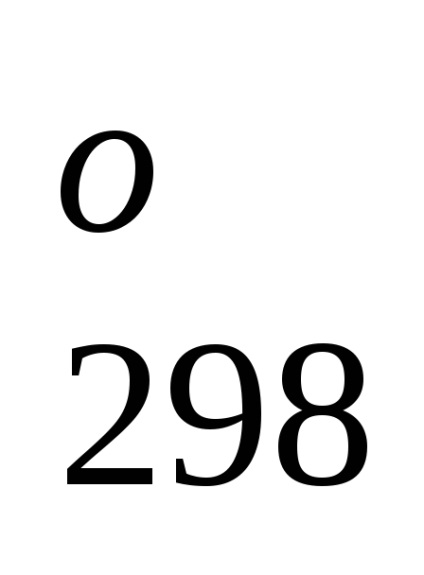
C6 H6 (g) + 7
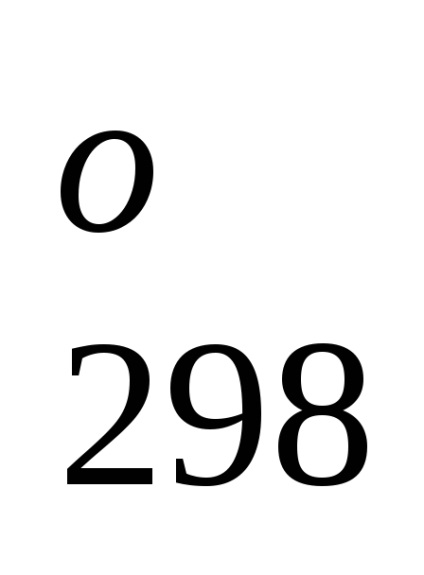
N2 +
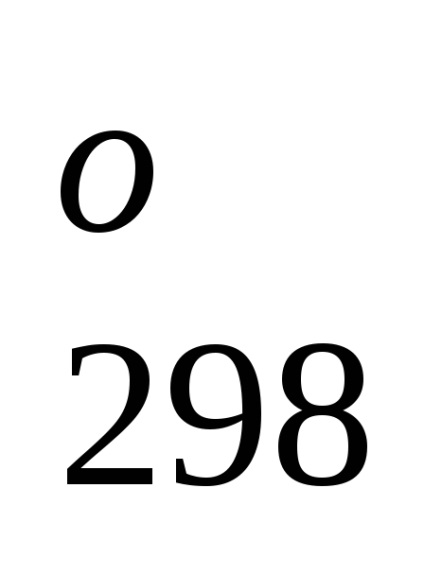
Entalpiája képződése kémiai vegyületek.
Entalpia (hő) obrazovaniyahimicheskogo soedineniyaNTnazyvaetsyaizmenenie entalpia gyártása során egy mól a kapcsolt-CIÓ egyszerű anyagok, stabil egy adott hőmérsékleten.
Standartnoyentalpiey (hő) formájában-zovaniyahimicheskogo soedineniyaN
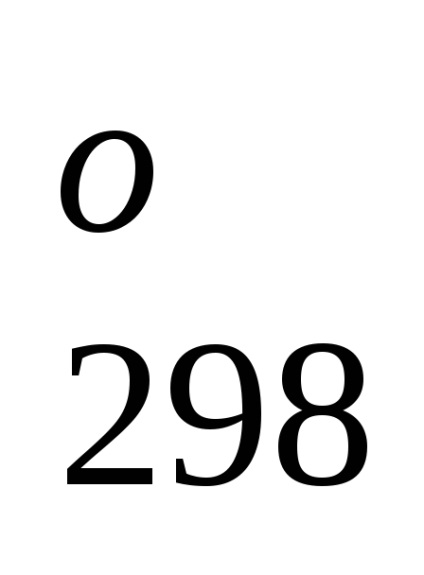
A standard képződési entalpia egyszerű anyagok Prien mayutsya ravnyminulyu, ha azok összesített Államok és módosítása a katsii-stabil standard körülmények között. Így például, egyenlő nulla szabványos képződéshő folyékony brómot (helyett gáz halmazállapotú) és grafit (inkább, mint a gyémánt).
Szabványos entalpiyaobrazovaniya vegyületet - egotermodinamicheskoy stabilitásának mértéke, szilárdság, kvantitatív expresszióját az energia-kapcsolat tulajdonságait.
Termokémiai számítások. Az alapja a legtöbb termohimi iCal-elszámolás következtében a törvény a Hess. ef-fect termális kémiai reakció egyenlő a hőmennyiség (entalpia) képező reakciótermék mínusz az összeget a futamok (entalpiák) képező kiindulási anyagok, tekintettel a sztöchiometriai arányok a reakció egyenletben.
(9) egyenlet lehetővé teszi, hogy meghatározzuk a reakció-hő által ismert képződéshő anyagok a reakcióban résztvevő komponensek és egyik képződéshő, ha az ismert reakcióhő és a többi entalpiája kialakulását.
Standard képződési entalpia jelentése energetiche-lefölözött hatást végbemenő folyamat állandó tempera-körben. A referenciaadat-, amelyek kapcsolódnak a 298 K, akkor lehet számítani, a reakcióhő, áramló-nek ezen a hőmérsékleten. Azonban, amikor teljesítő termokémiai számítások feltételezve általában kisebb hiba-ku, fel tudjuk használni átalányértékeket melegíti Obra-mations akkor is, ha a folyamat a feltételek, eltér a szokásos.
A hőhatás a fázis változása. Fázis-konv scheniya gyakran kísérő kémiai reakciók. Azonban, hő-TIONS hatásait fázisátalakulások hajlamosak a hő kevésbé O-hatásait kémiai reakciók. Az alábbiakban néhány példa termokémiai egyenletek fázis átalakulások:
H2 O (g) H2O (g). H
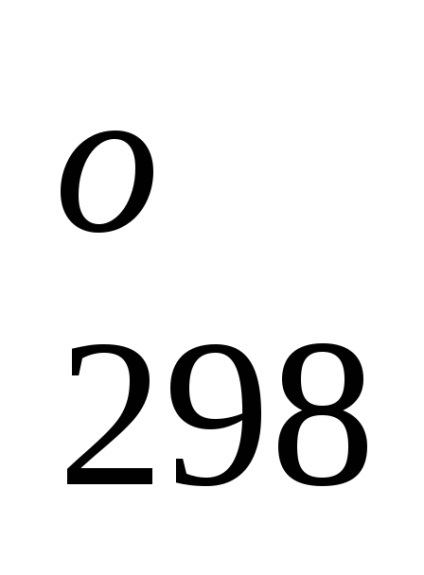
H2 O (k) H2 O (g). H