Elements viia alcsoportok
Hahanina TI Nikitina NG Grebenkova VI Shutov RF
Laboratóriumi gyakorlati munka során „Szervetlen Kémia” .-
A laboratóriumi munka arány „Szervetlen Kémia”, kiegészítve alkalmazási példáit kémiai folyamatok a mikroelektronikai és az ökológiai környezet értékelésére közegben. Laboratóriumi workshop tanulók részére ajánlott Kar etmo szakosodott területén a „Környezetvédelmi Engineering”, valamint az anyagok és eljárások a mikroelektronika.
Nikitina Nina Georgievna,
Grebenkova Valentine losifovna,
Hahanina Tatyana Ivanovna,
Shutov Raisa Frolovna.
Laboratóriumi gyakorlati munka során
Fluor-, klór-, bróm-, jódatom, asztácium képeznek VPA alcsoport van egy külső konfigurációs szint 2 p 5 ns asztácium mesterségesen előállított, radioaktív felezési
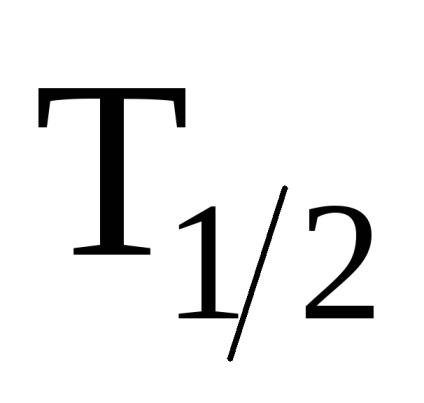
Szokásos körülmények között végzett kétatomos halogén-molekulákat, és léteznek a T2 (eltérően elemek VIIB alcsoport).
Oldhatóság különböző oldószerekben halogénatomok lehetnek egy jól illusztrálja a szabály „mint feloldódik, mint a”. Apoláros halogén-molekulákat gyengén oldódnak vízben, jól - a nem-poláros szerves oldószerek (benzol, toluol, és CC1 al.). Jó képes feloldani a szerves oldószerek az extraháláshoz használt vizes oldatok halogénatom extrakciós módszer.
Reaktivitás halogének fluor- jód csökken. Így, a fluor reakcióba lép szinte minden elemét szobahőmérsékleten (még a arany és platina), néhány reakciók klór- csak hevítve brómatom, a reakció hőmérséklete is magasabb lesz, a jód mellett is erős melegítés reagáltatunk egy korlátozott számú elemet.
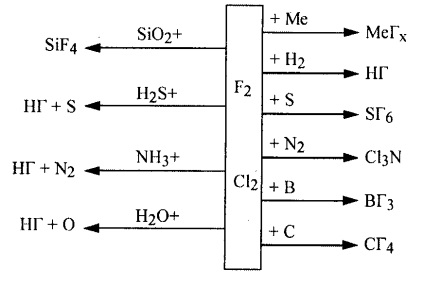
Kölcsönhatás legaktívabb fluor- és klóratom, egyszerű és komplex anyagokat lehet képviseli a rendszer:
Fluorsav utal savak közepes szilárdságú, mert vizes oldatban hidrogén-ionok a részlegesen megkötött ionok HF2 -. De finom HF komplexképző szer, ez része a sok etchants fémek és félvezetők, üveg, szilikon, stb Ion F nem csökkenti .; Cl-ion lehet egy redukálószer tömény sósavas oldatok (NaCl nem a redukálószer), és Br F csökkentése teljesítmény növekszik; KI - az egyik leggyakoribb redukálószerek.
Az oxigén vegyületek összes halogén kifejtett pozitív oxidációs állapotban, más, mint fluoratom. Így, klóratom lehet pozitív oxidációs állapotban +1, +3, +5, +7 (tabl.l. 1).
Oxigén klórtartalmú vegyület
Bróm és jód oxidációs állapotát +7 nem jellemző rájuk a leginkább stabil oxidációs állapotban +5:
A letöltés folytatásához össze kell rakni egy képet: