A korrózió sebessége a fém és a korróziós potenciálját
Fém korrózió sebessége általában meghatározott áramlási sebességek konjugátum elektrokémiai reakciók a korróziós potenciálját:
Amikor a felvétel részleges áramok egyenlet kell vizsgálni a részletes mechanizmusa katódos és anódos reakciók ilyen körülmények között. Egyes esetekben, az egyenlet a korróziós sebesség lehet csökkenteni formájában ICOR = Ik2 = IA1 (ahol Ik2 - regenerálás oxidálószer; IA1 - fém oldódási sebesség) cikkére kapott expressziós a korróziós potenciál, és a sebesség a korróziós folyamatot.
Tegyük fel, hogy a sebesség mindkét folyamat korlátozza az elektron transzfer lépés. majd:
Átalakítja ezt az egyenletet, megkapjuk:
Így, ismerve az érték a kinetikai mérések # 945; * és k2 # 945; * a1. juthat a függőség a korróziós potenciálját az oxidálószer koncentrációjának. Behelyettesítve a kifejezés Ekor az előző egyenlet, azt látjuk, a korrózió sebessége egy fém (sűrűsége korróziós áram)
Azonos kapott egyenlet által expressziós potenciálok tial korrózió helyettesített be a jobb oldalon az egyenlet a korrózió sebességét.
Ebből következik, hogy egyenletek
ahol értékeket kapunk # 945; * és k2 # 945; * a1.
Tekintsünk most egy konkrét példát a cink korróziós savas oldatokban. Mivel a hidrogén sebességét evolúció a cink korlátozza az elektronátvivő lépést és # 945; * k2 = # 945; k2 = 0,5, és az oldódási sebessége cink - hasítási lépést a második elektron, azaz .. # 945; * a1 = 1 + # 945; a1 = 1,5, (at # 945; a1 = # 945; k2 = 0,5), majd az egyenlet a korrózió mértéke a következőképpen írható fel:
Belőle megkapjuk az egyenlet a korróziós potenciál:
Így, ellentétben a egyensúlyi potenciálja a fém elektród, a korróziós potenciál független ak-konyság fémionok, de függ az oldat pH-ját. Ez az egyenlet jól támogatja a kísérleti adatok Liun-Sok, ábrán látható. 14.3.
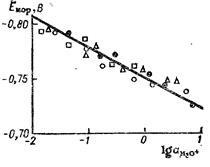
Ábra. 14.3. A függőség a korróziós potenciálját a cink elektród a logaritmusát a tevékenység a hidrónium ionok.
Különböző pontjain felelnek meg a különböző kísérletsorozatban. Közvetlen tartott az érték a szögletes együttható 0,03.
Behelyettesítve egyenlet Ekor az egyenletben a sűrűsége a korróziós áram, megkapjuk a legfrissebb függés az oldat savasságát:
Ha a korrózió a vas a gyengén savas oldatok visszanyerési aránya oxidálószer által korlátozott diffúziós lépés (Ya. V. Durdin). Következésképpen, ebben az esetben, a korróziós áramsűrűség egyenlő az áramsűrűség határértéknél helyreállítási hidróniumionok és fém ionizációs áramsűrűség
Következésképpen, a korróziós potenciált és a korrózióval áramsűrűség függ az áramkorlátozás, és ezáltal az intenzitást a keverés közben.
Azokban az esetekben, amikor az értéke a korróziós potenciált, közel a egyensúlyi potenciálja egyik párosított elektrokémiai reakciók, korrózió sebessége a fém lehet kiszámítani helyettesítve a kifejezéseket az egyenlet a egyensúlyi potenciáljának a korróziós áramsűrűség. Például, a korróziós viselkedését a nátrium-amalgám savas közegben jellemzi a túlsúlyban anódrekció
és a katód reakció:
Összhangban az egyenlet a sűrűsége a korróziós áram, figyelmen kívül hagyva a kiáramlási sebességeit nátrium ionok és hidrogén ionizációs, tudjuk írni:
Mivel a magas csereáramsűrűség fölött nátrium-amalgám és vizes oldatok, valamint nagy túlfeszültséget hidrogén fejlődése, beállítja az értéket a korróziós potenciál a mérési hibahatáron belül gyakorlatilag megegyezik az egyensúlyi potenciáljának amalgám elektróda:
Behelyettesítve ezt az egyenletet az előző, megkapjuk azt a kifejezést bomlási sebessége az amalgám:
A következő egyenletből következik, hogy a korrózió mértéke savas rastvopax pH-függő. feltéve, hogy # 945 * k2 ≈ 0,5, megkapjuk egyenletet állandó és
amely alkáli-amalgám savas oldatokban kísérletileg megerősítették Bronsted és Kane. A megoldások a magas pH-jú (pH> 10), amikor a hidrogén-fejlődés megy végbe, mint eredményeként a kisülési vízmolekulák, a korróziós sebességét az amalgám nem függ az oldat pH-ját.
Ha megváltoztatja a kompozíciót az oldat elengedhetetlen amalgámbomlási sebesség (különösen hidrogén fejlődést a katód; .., lásd a 11) biztosítja a változás # 968; „- lehetséges. Behelyettesítve a kifejezés az amalgámot a egyensúlyi potenciáljának egyenletet a mentesítés hidróniumionok vagy vízmolekulák a # 968; „- a kapacitás, illetve megkapjuk:
Ezek az egyenletek képviseli a kísérletileg meghatározott függését a korrózió sebessége a alkáli-amalgám összetétele és koncentrációja az oldat és az amalgám, amíg a pH ≈ 10. Magasabb pH amalgámbomlási sebesség lineárisan függ a koncentrációtól. A magyarázat ez a tény képezi egy kémiai mechanizmust amalgámbomlási lúgos oldatok, amelyek alapja az a feltételezés, hogy egy közvetlen kölcsönhatása az amalgám vízzel:
A bomlás sebessége az amalgám összhangban ezt a reakciót
Ez nem függ az összetételtől és az oldat pH. A törvények a természet-WIDE kémiai mechanizmust, kimutatott szol-rénium szilícium lúgos oldatok, vas, króm, mangán és króm acél savak (YM Kolotyrkin, T. R. Agladze és alkalmazottak).
A kioldódási sebességet mind amalgámok alkáli- és alkáliföldfémek és kemény fémek korrózió a konjugátum hidrogén fejlődés reakcióját általában lehet alábbi egyenlet fejezi ki
ahol - a kisülési sebességének a hidróniumionok; - a sebességet a kisülési vízmolekulák; - a sebessége a kémiai kölcsönhatás mechanizmusát.