A kémiai kinetika - a problémák megoldását a kontroll



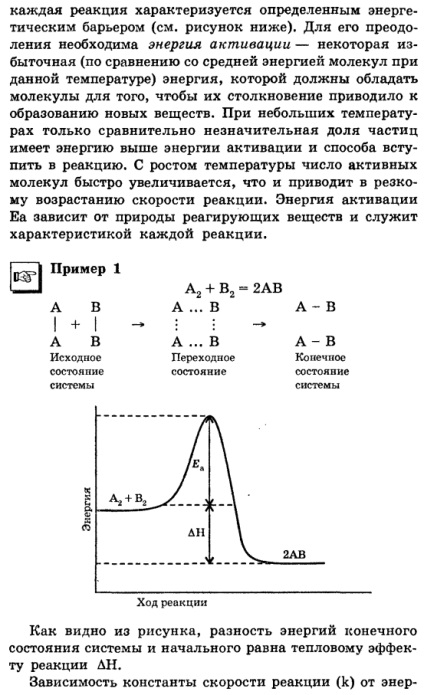







A kémiai reakciók sebességének KATEGÓRIA kémia, sebessége és mechanizmusa vizsgálatok kémiai reakciók nevezzük kémiai kinetika. A kémiai reakciók sebességének - az a szám elemi események kölcsönhatás egységnyi idő egységnyi reakció-térfogatban. Ez a meghatározás érvényes mind a homogén és heterogén folyamatokat. Az első esetben, a reakció kamra térfogata a reakcióedénybe, és a második - olyan felülettel rendelkezik, amely a reakció előrehalad. Mivel a változás a kölcsönhatás a reagensek vagy a termék koncentrációja egységnyi reakcióidő. Nincs szükség, hogy figyelemmel kíséri a koncentráció változását valamennyi anyag vesz részt a reakcióban, mint stehiomet - paraméter egyenlet az létrehozza közötti kapcsolat a koncentrációt az reagensek. gyakran a reaktánsok koncentrációja van kifejezve mól 1 liter (mol / l). A reakció sebessége függ a természet a reagensek, koncentrációk, hőmérséklet, a felület közötti érintkezési anyagok és a jelen lévő más katalizátorok. [TJ koncentrációjának növelése a reagensek növekedéséhez vezet a kémiai reakció sebessége annak a ténynek köszönhető, hogy bármely kémiai reakció révén közötti ütközés reagáló részecskék (atomok, molekulák, ionok), és ezek nagyobb, a több jutó részecskék reakció térben (a nagyobb koncentráció) . A kémiai reakció mehet végbe egy vagy több elemi események (elemi reakciólépést). Egy sor elemi esemény tükrözi a mechanizmus a reakciót. Reakciók, amelyek megfelelnek minden ^ elemi jogszabály írhat kifejezése reakció sebessége a koncentráció alapján a reakció egyenlet. Abban az esetben, amikor elemi esemény részt csak egy molekula (például, bomlási reakció), a függőség a formában: u = k [A], és azt jelzik, a monomolekuláris reakció; amikor egy ütközés történik elemi aktus két különböző molekula, az összefüggés a következő: és - k [A], [B], és jelzi a bimolekuláris reakció; amikor egy ütközés történik elemi aktus három molekula sebessége koncentrációja függvényében érvényes: v - k [A] • [B] • [C], és azt jelzik, trimolekuláris reakciót. Minden szétszerelt függőségek: V- reakció sebességét; [A], [B], [C] - reaktánsok koncentrációja; k - arányossági tényező; úgynevezett állandó reakciósebesség. v = k, ha a koncentrációja a reagenseket, vagy a termék az egység. A sebességi állandó jellegétől függ a reagensek és a hőmérséklet. A függését sebességének egyszerű reakciók (m. E. fellépő keresztül egy elemi esemény) a koncentráció által leírt tömeghatás törvénye meghatározott Guldberg és P. K. Waage 1867-ben a kémiai reakció sebessége egyenesen arányos a termék a reagáló anyagok koncentrációit, hatványát azok sztöchiometriai arányok. Például, a reakciót 2NO + 02 = 2N02; v - k [NO] 2 [HL. Ha az egyenlet a kémiai reakció nem felel meg az általános jogszabály az interakció, és egyszerűen egy általános egyenlete, amely tükrözi csak a kapcsolat a tömeg lépett és a kapcsolódó anyagok írásakor kifejezést a függőség a reakció sebessége a koncentrációt meg kell vizsgálni, hogy milyen mértékben koncentrációban nem lehet egyenlő az együtthatók néző a képletek az anyagok a reakció egyenletben. A reakció, az áramlás a amely kapcsolatban van bizonyos elemi esemény, a teljes sebesség határozza (korlátozott) sebességet a leglassabb lépésben. Robbantott függését a reakció sebessége a reagensek koncentrációja érvényes gázok és reakciók oldatban. Ez nem vonatkozik a reakciót a szilárd anyag, mivel ezekben az esetekben nincs kölcsönhatás a molekulák a teljes térfogatban a reaktánsok, de csak a felszínen a két fázis között. Ezért a heterogén reakció sebessége nem csak attól függ a tényezőket korábban tárgyaltuk, hanem a felszínen közötti érintkezési reagáló fázisok. Bármilyen növelése a felület növekedéséhez vezet a reakció sebességét. UJ hőmérséklet hatását kémiai reakció sebessége összhangban van a szabály van't Hoff: az a hőmérséklet emelkedése minden 10 ° C-on a reakció sebessége nőtt 2-4 alkalommal. Matematikailag, ezt tipikusan által továbbított, a következő egyenlettel: t / f
ny, ahol A jelentése - együtthatót az arányosság e - a bázis a természetes logaritmus; R - egyetemes gázállandó és T - abszolút hőmérséklet. Ez az egyenlet azt mutatja, hogy az állandó hőmérséklet állandó sebesség határozza meg az aktiválási energia. Minél nagyobb a számérték az aktiválási energia, annál kisebb a reakcióelegyet az aktív molekulák, annál kisebb a száma a hatékony ütközések, és így csökkenti a sebességi állandó a kémiai reakció maga sebességet. [3) A hatás a katalizátor. Katalizátorok olyan anyagok, részt vesznek a kémiai folyamat, a változó sebességű, de nem része a reakciótermékek, azaz. E. A reakció végét marad kémiailag változatlan. A jelenséget a változása a reakció sebessége hatása alatt katalizátorok nevezett katalízis. Megkülönböztetése homogén és heterogén katalízis. Amikor az interaktív szer és a katalizátor ugyanabban halmazállapotban, beszélni homogén katalízis. A heterogén katalízis, a reagensek és a katalizátor különböző állapotaiban aggregáció; általában szilárd katalizátor és a reaktánsok - folyékony vagy gáz halmazállapotú. Ha a katalizátor csökkenti a kémiai reakció sebessége, ez az úgynevezett inhibitora. Bizonyos anyagokat nem katalitikus hatása, de azok additív drámai módon megnöveli a katalitikus képességét a katalizátort. Ezek az úgynevezett támogatói. Egyéb anyagok csökkentésére vagy teljes egészében zavarja a katalizátorok aktivitása említett katalizátor mérgező, és a folyamat csökkenti a katalizátor aktivitását - mérgezés. Amikor homogén katalízis alaphipotézisünk megmagyarázni a hatásmechanizmusa a katalizátor, ez az elmélet a köztitermékek és a katalizátor a reakció reagens alacsonyabb aktiválási energia. Heterogén katalízis gyakran magyarázható az adszorpciós elmélet, amely szerint az adszorpciós a reaktánsok és koncentrációját növeli a katalizátor felületén. Meg kell jegyezni, hogy a katalizátor jellemzi szelektivitás. 2. példa hányszor növeli a reakció sebessége a szén-monoxid interakció (II) oxigént, ha a koncentrációja a kiindulási anyagok, hogy növelje háromszor? Adott: [CO] és [02], hogy növelje háromszorosára Find: Megoldás: 1) írása a reakció egyenletet: 02 = 2CO + 2S02. Szerint a tömeghatás törvénye v - k [C0] 2 [02]. 2) Legyen [CO] = egy; [02] = b, akkor: v = egy a2 • • b. 3) Amikor a koncentrációja a kiindulási anyagokat kapjuk 3-szor: [CO] = Per és [02] = SL. 4) kiszámítja a reakció sebessége u1: - k9a23b - k27a% egy, ha K27 D2 27 v A2b: 27 alkalommal. 3. példa, hogy hányszor kell növelni a kémiai reakció sebessége a hőmérséklet növelésével akár 40 ° C-on, ha a hőmérséklet a reakció sebességi együttható RA vénába 3? Adott: At = 40 ° C Y - Find 3: Megoldás 2: 1) szerint a van't Hoff szabály: h-U vt2 = vh • a 10. a 40. és - vt> március 10 - vt -81. Február 1 1 Válaszok: 81 alkalommal. és 4. példa A vegyületek közötti reakciót az A és B átfolyik az áramkör 2A + B * „C. Az anyag koncentrációja A jelentése megegyezik a 10 mol / l, és az anyagot a B - b mol / l. A reakció sebességi állandója egyenlő 0,8 mól 4 n2 „2 • sec” 1. Számítsuk ki a vegyi reakciók arányát a kezdeti pillanatban, és a pillanat, amikor a reakciókeverék 60% az anyag B. Adott: a - 0,8 n2 • mol „2 • sec” 1 [A] = 10 mol / L [B] = 6 mol / l találni „^ nach Megoldás: 1) Find a reakció sebessége a kezdeti időben :! v - k [a] 2 • [b], r> = 0,8 • 102 • b - 480 mól - l • s „1. nach 2) Egy bizonyos idő után 60% az anyag marad a reakcióelegyben B. Ezután: Ezért, [B] csökkent 6-3,6 = 2,4 mol / l. 3) a reakció egyenletek az következik, hogy a A és B anyagok kölcsönhatásba a aránya 2: 1, úgy, hogy az [A] csökkent 4,8 mol / l, és egyenlő volt: [A] = 10-4,8 = 5,2 mol / l. 4) Számítsuk, ha: z> = 0,8 * 5,22 • 3,6 = 77,9 mol • L "1 * sec" 1. Válasz: d> Beg
480 mol • L • sec "1, g / mol = 77,9 • L-1 • sec" 1. 5. példa reagáltatjuk 30 ° C-on megy végbe, két percig. Az, hogy mennyi ideig ez a reakció fut hőmérsékleten 60 ° C, ha ebben a hőmérséklettartományban a reakció hőmérséklete sebességi együttható egyenlő 2? Összefüggés adja meg: t1 = 30 ° C T2 = 60 ° C-on 7 = 2, t = 2 min = 120 sec Find: óra 1. oldat) A szabálynak megfelelően van't Hoff: VT - = y W 1 VT - = 23 = 8. vt 2) a reakció sebessége fordítottan arányos a reakcióidő, tehát: a: t = 15s. Kérdések és feladatok önrendelkezés 1. Adjon meghatározása a reakció sebességét. Adjon példákat fellépő különböző sebességgel. 2. A kifejezés tényleges sebességet a kémiai reakció előforduló állandó térfogaton rendszer, van írva a következő: dC V = ± -. d t Adja meg, milyen esetekben pozitív, és néhány - negatív előjellel a jobb oldalon a kifejezés. 3. Milyen tényezők mértékétől függ a kémiai reakció? 4. Az úgynevezett aktiválási energia? A hatás olyan tényezőt, a vegyi reakciók arányát írja le? 5. Miért olyan erős növekedése reakció sebessége a hőmérséklet emelkedésével? 6. Adja meghatározása alaptörvénye kémiai kinetika - a tömeghatás törvénye. Ki és mikor alakult? 7. Az úgynevezett sebességi állandója egy kémiai reakció, és milyen tényezők függvénye? 8. Mi a katalizátort, és hogyan befolyásolja a vegyi reakciók arányát? 9. Adjon példákat a folyamatok, amelyek az inhibitorokat használnak. 10. Mi a promóterek és hol használják őket? 11. Mely anyagokat nevezzük „katalizátor mérgek”? Példákat mutatnak ilyen anyagok. 12. Mi a homogén és heterogén katalízis? Hozd példák segítségével a folyamatok a katalitikus folyamatok. 13. Ahogy változik a reakció sebessége 02 = + 2S0 2S02, ha csökkenti a hangerőt a gázkeverék 2-szer? 14. Hányszor növeli a sebességét kémiai reakció, a hőmérséklet emelkedik 10 ° C-tól 40 ° C-on, ha ismert, hogy a hőmérséklet emelkedik 10 ° C-on a reakció sebességét növeli 2-szer? 15. A reakció sebességét az A + B = C, mint a hőmérséklet emelkedik minden 10 ° C-ra növeljük háromszoros. Hányszor növeli a reakció sebességét, amikor a hőmérséklet eléri a 50 ° C? 16., hogy hányszor kell növelni a reakció sebességét az interakció a hidrogén és a bróm, ha a koncentráció a kiindulási anyagok növelik 4-szer? 17. Hányszor reakció sebességének megnövelése a hőmérséklet emelkedésével akár 40 ° C-on (V = 2)? 18. Hogyan változtassuk meg a reakció sebességét 2NO + 02 ^ 2N02, ha a nyomás a rendszerben a kettős? 19. Hányszor kell növelni a hidrogén koncentrációját az a rendszer N2 + 3H2 ^ 2NH3, a reakció sebessége nőtt 125-szor? 20. A reakciót közötti nitrogén-oxid (II) és a klór zajlik egyenlet szerint 2NO + C12 2NOC1; hogyan lehet megváltoztatni a reakció sebességének növelésével: a) a nitrogén-monoxid a felére; b) Klór koncentráció kétszerese; c) a koncentráció a két anyag kétszer. 21. A 150 ° C-on a reakció befejeződik körülbelül 16 perc. Figyelembe a hőmérsékleti együttható egyenlő 2,5, számítani, ami után idő alatt, ugyanaz a reakció 80 ° C-on 22. hány fokkal a hőmérsékletet növelni kell, a reakció sebessége nőtt 32-szer. A hőmérséklet a reakció sebességi állandója egyenlő 2 23. A 30 ° C-on a reakció lefolyását, 3 percig. Az, hogy mennyi ideig ez eljárni, mint a reakció 50 ° C-on, ha a hőmérséklet a reakció sebességi együttható értéke 3. 24. A hőmérséklet 40 ° C-on a reakció lefolyását 36 percig, majd 60 ° C-on - 4 min. Számítsuk ki a hőmérsékleti együtthatója a reakció sebességét. 25. A reakció sebessége 10 ° C-on 2 mol / l. Számítsuk ki a reakció sebességét 50 ° C-on, ha a hőmérséklet a reakció sebességi együttható értéke 2.